Что такое кадмий? Это тяжелый металл, который получается в результате выплавки других металлов, таких как цинк, медь или свинец. Его широко используют для изготовления никель-кадмиевых аккумуляторов. Кроме того, сигаретный дым также содержит такой элемент. В результате непрерывного воздействия кадмия возникают очень тяжелые заболевания легких и почек. Рассмотрим особенности этого металла более подробно.
Сфера применения кадмия
Большая часть промышленного использования этого металла приходится на защитные покрытия, которые предохраняют металлы от коррозии. Такое покрытие имеет большое преимущество перед цинковыми, никелевыми или оловянными, потому что при деформации оно не отслаивается.
Какое еще может быть применение кадмия? Он используется для производства сплавов, которые замечательно поддаются механической обработке. Сплавы кадмия с незначительными добавками меди, никеля и серебра применяют для изготовления подшипников автомобильных, авиационных и судовых двигателей.
Мнение эксперта:
Получение особо чистого кадмия является важной задачей в современной промышленности. Эксперты отмечают, что кадмий, как тяжелый металл, имеет высокую токсичность и может негативно влиять на организм человека. Поступление кадмия в организм может привести к различным заболеваниям, таким как повреждение почек, печени и легких, а также костей. Поэтому важно обеспечить контроль за уровнем кадмия в окружающей среде и продуктах питания, а также развивать методы получения особо чистого кадмия, чтобы минимизировать его воздействие на здоровье человека.

Где еще используется кадмий?
Сварщики, металлурги и работники, связанные с текстильной, электронной промышленностью и производством аккумуляторов, чаще других подвергаются риску отравлением кадмием. Никель-кадмиевые аккумуляторы применяются в мобильных телефонах и прочих электронных устройствах. Используется этот металл также в производстве пластика, красок, металлических покрытий. Многие почвы, которые регулярно удобряют, также могут содержать такой токсичный металл в большом количестве.
Интересные факты
- Кадмий является одним из самых токсичных металлов для человека. Он может накапливаться в организме и вызывать различные заболевания, включая рак, почечную недостаточность и остеопороз.
- Получение особо чистого кадмия является сложным и дорогостоящим процессом. Для этого используется метод электролитического рафинирования, который позволяет удалить из кадмия примеси других металлов.
- Кадмий используется в различных отраслях промышленности, включая производство аккумуляторов, красок, пластмасс и сплавов. Однако из-за своей токсичности его применение постепенно сокращается.

кадмий: свойства
Кадмий, а также его соединения характеризуются как но не было доказано, что не
большое количество
элемента в окружающей среде вызывает раковые заболевания. Вдыхание частиц металла на
промышленном производстве
действительно способствует развитию рака легких, но при употреблении зараженной пищи они не представляют опасности развития рака.
Опыт других людей
Получение особо чистого кадмия вызывает разносторонний интерес у людей. Одни утверждают, что этот металл способен оказывать негативное влияние на организм человека, вызывая различные заболевания, включая проблемы с почками и печенью. Другие же утверждают, что кадмий может быть полезен в промышленности и медицине. Важно помнить, что воздействие кадмия на организм зависит от его концентрации и способа воздействия. Поэтому необходимо соблюдать предосторожность при работе с этим веществом и следить за его уровнем в окружающей среде.

Каким образом кадмий попадает в организм человека?
Уже давно всем известно, что сигаретный дым содержит кадмий. Этот тяжелый металл поступает в организм курильщика в количестве, в два раза большем, чем в организм человека, который не подвержен такой
вредной привычке
. Однако пассивное курение способно нанести вред.
Листовые овощи, злаки и картофель, выращенные на почве, содержащей большое количество кадмия, могут нести в себе угрозу. Повышенным содержанием этого металла также славится печень и почки морских обитателей и животных.
Многие промышленные предприятия, особенно металлургические, выделяют в атмосферу большое количество кадмия. Люди, проживающие около таких предприятий, автоматически заносятся в группу риска.
Некоторые сельскохозяйственные районы активно применяют фосфатные удобрения, которые содержат незначительное количество кадмия. Продукты, выращенные на этой земле, представляют для человека потенциальную угрозу.
Воздействие кадмия на организм человека
Таким образом, мы разобрали, что представляет собой кадмий. Влияние на организм человека этого тяжелого металла может вызвать негативные последствия. В любом живом организме он находится в незначительном количестве, и его биологическая роль до сих пор до конца не выяснена. Обычно кадмий ассоциируется с негативной функцией.
Его токсичное воздействие основано на блокировке серосодержащих аминокислот, что приводит к нарушению белкового обмена и поражению ядра клетки. Этот тяжелый металл способствует выводу кальция из костей и поражает
нервную систему
. Может накапливаться в почках и печени, а выводится из организма он очень медленно. Этот процесс может занимать десятилетия. Обычно кадмий выводится с мочой и калом.
Вдыхание кадмия
Этот элемент попадает в организм работников промышленности при вдыхании. Чтобы не допустить этого, используют эффективные защитные средства. Пренебрежение этим правилом приводит к печальным последствиям. Если вдохнуть кадмий, влияние на организм человека такого металла проявляется следующим образом: повышается температура тела, появляется озноб и боли в мышцах.
Через некоторое время происходит повреждение легких, возникает боль в груди, одышка, кашель. В тяжелых случаях такое состояние вызывает смерть больного. Вдыхание воздуха, содержащего кадмий, способствует развитию заболеваний почек и остеопороза. Вероятность рака легких повышается в несколько раз.
Поступление кадмия вместе с пищей
Чем опасен кадмий в воде и пище? При регулярном употреблении зараженных продуктов и воды в организме начинает накапливаться этот металл, что приводит к
негативным последствиям
: нарушается работа почек, происходит ослабление костной ткани, поражается печень, сердце, а в тяжелых случаях наступает смерть.
Употребление продуктов, загрязненных кадмием, может спровоцировать раздражение желудка, тошноту, боль в животе, диарею и рвоту. Кроме этого, появляются симптомы, напоминающие грипп, развивается отек гортани и возникает покалывание в руках.
Причины отравления кадмием
Отравление тяжелыми металлами чаще всего происходит у детей, диабетиков, беременных и кормящих женщин, людей, злоупотребляющих курением. В Японии интоксикация организма кадмием происходит в результате употребления загрязненного риса. В этом случае развивается апатия, поражаются почки, кости размягчаются и деформируются.
Промышленно развитые районы, в которых располагаются нефтеперерабатывающие и металлургические предприятия, славятся тем, что там почва загрязнена кадмием. Если в таких местах выращивают растительную продукцию, то велика вероятность того, что произойдет отравление тяжелыми металлами.
Элемент в больших количествах может накапливаться в табаке. Если сырье высушивается, то содержание металла резко увеличивается. Поступление в организм кадмия происходит как при активном, так и при Возникновение рака легких напрямую зависит от содержания в дыме металла.
Лечение при отравлении
Кадмием:
- поражение центральной нервной системы;
- острые боли в костях;
- белок в моче;
- камни в почках;
- дисфункция половых органов.
Если произошло острое отравление, пострадавшему следует находиться в тепле, ему необходимо обеспечить приток свежего воздуха и покой. После промывания желудка ему нужно дать
теплое молоко
, в которое добавляют немного пищевой соды. Не существует каких-либо антидотов кадмия. Чтобы нейтрализовать металл, используют «Унитиол», стероиды и мочегонные препараты. Комплексное лечение предусматривает применение антагонистов кадмия (цинк, железо, селен, витамины). Врач может назначить общеукрепляющую диету, содержащую большое количество клетчатки и пектиновых веществ.
Возможные последствия
Такой металл, как кадмий, влияние на организм человека оказывает очень серьезное, а если произошло отравление этим элементом, то последствия могут быть опасными. Он вытесняет кальций из костей, способствуя развитию остеопороза. У взрослых и детей начинает искривляться позвоночник и происходит деформация костей. В детском возрасте подобное отравление приводит к энцефалопатии и нейропатии.
Вывод
Таким образом, мы разобрали, что представляет собой такой тяжелый металл, как кадмий. Влияние на организм человека этого элемента довольно серьезное. Постепенно накапливаясь в организме, он приводит к разрушению многих органов. Можно даже отравиться кадмием, если употреблять в большом количестве зараженные продукты. Последствия отравления также достаточно опасные.
Кадмий (латинское Cadmium, обозначается символом Cd) — элемент с атомным номером 48 и атомной массой 112,411. Является элементом побочной подгруппы второй группы, пятого периода периодической системы химических элементов Дмитрия Ивановича Менделеева. При нормальных условиях простое вещество кадмий — тяжелый (плотность 8,65 г/см3) мягкий ковкий тягучий переходный металл серебристо-белого цвета.
Природный кадмий состоит из восьми изотопов, шесть из которых стабильны: 106Cd (изотопная распространённость 1,22 %), 108Cd (0,88 %), 110Cd (12,39 %), 111Cd (12,75 %), 112Cd (24,07 %), 114Cd (28,85 %). Для двух других природных изотопов обнаружена слабая радиоактивность: 113Cd (изотопная распространённость 12,22 %, β-распад с периодом полураспада 7,7∙1015 лет) и 116Cd (изотопная распространённость 7,49 %, двойной β-распад с периодом полураспада 3,0∙1019 лет).
Сорок восьмой элемент периодической системы был открыт немецким профессором Фридрихом Штромейером в 1817 году, это открытие можно назвать случайным. Дело в том, что провизоры Магдебурга при изучении препаратов, содержащих оксид цинка ZnO, заподозрили в них присутствие мышьяка. Так как окись цинка входит в состав многих мазей, присыпок и эмульсий, применяемых при различных кожных болезнях, проверяющие категорически запретили продажу всех подозрительных лекарств. Естественно, что производитель лекарственных препаратов, отстаивая свои интересы, потребовал независимой экспертизы. В роли эксперта выступил Штромейер. Он выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который был им назван «кадмием» (от греч. kadmeia — нечистый оксид цинка, также цинковая руда). Независимо от профессора Штромейера кадмий был обнаружен в силезских цинковых рудах группой немецких ученых — К. Германом, К. Карстеном и В. Мейснером в 1818 году.
Кадмий хорошо поглощает медленные нейтроны, по этой причине кадмиевые стержни применяют в ядерных реакторах для регулирования скорости цепной реакции. Кадмий используется в щелочных аккумуляторах, входит как компонент в некоторые сплавы. Так, например, сплавы меди, содержащие порядка 1 % Cd (кадмиевые бронзы), служат для изготовления телеграфных, телефонных, троллейбусных проводов, так как эти сплавы обладают большей прочностью и износостойкостью, чем медь. Ряд легкоплавких сплавов, например, применяющиеся в автоматических огнетушителях, содержат сорок восьмой элемент. Кроме того, кадмий входит в состав некоторых ювелирных сплавов. Этот металл применяется для кадмирования стальных изделий, ведь он несет на своей поверхности оксидную пленку, обладающую защитным действием. Дело в том, что в морской воде и в ряде других сред кадмирование более эффективно, чем цинкование. Кадмий имеет долгую историю использования в гомеопатической медицине. Широкое применение нашли и соединения сорок восьмого элемента — сульфид кадмия применяется для изготовления желтой краски и цветных стекол, а фтороборат кадмия — важный флюс, применяемый для пайки алюминия и других металлов.
Кадмий обнаружен в организме всех позвоночных животных, установлено, что он влияет на углеродный обмен, активность ряда ферментов и синтез гиппуровой кислоты в печени. Однако соединения кадмия ядовиты, а сам металл является канцерогеном. Особенно опасно вдыхание паров оксида кадмия CdO, нередки случаи со смертельным исходом. Вредно и проникновение кадмия в желудочно-кишечный тракт, но случаев смертельного отравления не зафиксировано, вероятнее всего это связано с тем, что организм сам стремится избавиться от токсина (рвота).
Биологические свойства
Оказывается, кадмий присутствует практически во всех живых организмах — в наземных содержание сорок восьмого элемента приблизительно равно 0,5 мг на 1 кг массы, в морских организмах (губки, кишечнополостные, иглокожие, черви) — от 0,15 до 3 мг/кг, содержание кадмия в растениях составляет порядка 10-4 % (на сухое вещество). Несмотря на присутствие кадмия в большинстве живых организмов, его специфическое физиологическое значение пока достоверно не установлено. Ученым удалось выяснить, что этот элемент влияет на углеводный обмен, на синтез в печени гиппуровой кислоты, на активность ряда ферментов, а также на обмен в организме цинка, меди, железа и кальция. Существует предположение, обоснованное некоторыми исследованиями, что микроскопические количества кадмия в пище могут стимулировать рост у млекопитающих. По этой причине некоторые ученые причисляют кадмий к условно-эссенциальным микроэлементам, то есть жизненно-важным, но токсичным в определенных дозах. Даже в организме вполне
здорового человека
содержится небольшое количество кадмия. И все-таки, несмотря на это, кадмий относят к наиболее токсичным тяжелым металлам — Российским СанПиНом он отнесен ко 2-му классу опасности — высокоопасные вещества — куда входят также сурьма, стронций, фенол и другие отравляющие вещества. В бюллетене «Проблемы химической безопасности» от 29 апреля 1999 года кадмий фигурирует как «наиболее опасный экотоксикант на рубеже тысячелетий»!
Как и прочие тяжелые металлы, кадмий является кумулятивным ядом, то есть, он способен накапливаться в организме — период его полувыведения составляет от 10 до 35 лет. Человеческий организм к пятидесяти годам способен накопить от 30 до 50 мг кадмия. Основными «депо отложения» сорок восьмого элемента в человеческом теле являются почки, содержащие от 30 до 60 % суммарного количества этого металла в организме, печень (20-25 %). В меньшей степени накапливать кадмий способны: поджелудочная железа, селезенка, трубчатые кости, другие органы и ткани. В небольших количествах сорок восьмой элемент присутствует даже в крови. Однако, в отличие от свинца или ртути, кадмий не проникает в мозг. По большей части кадмий в организме находится в связанном состоянии — в комплексе с белком-металлотионеином — это своеобразный защитный механизм, реакция организма на присутствие тяжелого металла. В таком виде кадмий менее токсичен, однако, даже в связанном виде он не становится безвредным — накапливаясь годами этот металл способен привести к нарушению работы почек и повышенной вероятности образования почечных камней. Намного опаснее кадмий, находящийся в ионной форме, ведь он химически весьма близок к цинку и способен замещать его в биохимических реакциях, выступая в качестве псевдоактиватора или, наоборот, ингибитора содержащих цинк белков и ферментов. Кадмий связывается с цитоплазматическим и ядерным материалом клеток и повреждает их, изменяет активность многих гормонов и ферментов, что объясняется его способностью связывать сульфгидрильные (-SH) группы. Кроме того, сорок восьмой элемент, в связи с близостью ионных радиусов кальция и кадмия, способен замещать кальций в костной ткани. Такая же ситуация с железом, которое кадмий также способен замещать. По этой причине недостаток кальция, цинка и железа в организме способен привести к повышению усвояемости кадмия из желудочно-кишечного тракта до 15-20 %. Считается, что безвредной суточной дозой кадмия для взрослого человека является 1 мкг кадмия на 1 кг собственного веса, большие количества кадмия чрезвычайно опасны для здоровья.
Каковы же механизмы поступления кадмия и его соединений в организм? Отравление происходит при употреблении воды (ПДК для
питьевой воды
составляет 0,01 мг/л), загрязненной кадмиесодержащими отходами, а также при употреблении в пищу овощей и зерновых, произрастающих на землях, расположенных вблизи от нефтеперегонных заводов и металлургических предприятий. Особо опасно употребление грибов с таких территорий, так как они, по некоторым сведениям, способны накапливать более 100 мг кадмия на кг собственного веса. Курение — еще один источник поступления кадмия в организм, причем, как самого курящего, так и окружающих его людей, ведь металл находится в табачном дыме. Характерными признаками хронического отравления кадмием являются, как говорилось ранее, поражения почек, боли в мышцах, разрушение костной ткани, анемия. Острое пищевое отравление кадмием наступает при поступлении больших разовых доз с пищей (15-30 мг) или с водой (13-15 мг). При этом наблюдаются признаки острого гастроэнтерита — рвота, боли и судороги в эпигастральной области, однако случаи смертельного отравления соединениями кадмия, попавшими в организм с пищей, науке неизвестны, но по оценкам ВОЗ летальная разовая доза может составлять 350-3500 мг. Гораздо опаснее отравление кадмием при вдыхании его паров (CdO) или кадмийсодержащей пыли (как правило, это происходит на связанных с использованием кадмия производствах). Симптомами подобного отравления являются отек легких, головная боль, тошнота или рвота, озноб, слабость и диарея. В результате таких отравлений были зафиксированы смертельные случаи.
Противоядием при отравлении кадмием является селен, который способствует снижению усвояемости сорок восьмого элемента. Однако требуется сбалансированный прием селена, связано это с тем, что избыток его в организме приводит к снижению содержания серы, а это обязательно приведет к тому, что кадмий вновь станет легко усваиваться организмом.
Установлено, что одна сигарета содержит от 1 до 2 мкг кадмия. Выходит, что человек, выкуривающий за день хотя бы пачку сигарет, получает дополнительно порядка 20 мкг кадмия, как минимум! Опасность заключается и в том, что усвояемость сорок восьмого элемента через легкие максимальна — от 10 до 20 %, таким образом, в организме курильщика усваивается от 2 до 4 мкг кадмия с каждой пачкой сигарет! Канцерогенное действие никотина, содержащегося в табачном дыме, как правило, связано с присутствием кадмия, причем он не задерживается даже угольными фильтрами.
Пример массового хронического отравления кадмием с многочисленными смертельными исходами был описан в конце 50-х годов XX века. На территории Японии были зафиксированы случаи массового заболевания, которое местные жители прозвали «итай-итай», что дословно можно перевести, как «ой-ой, как больно!». Симптомами болезни были сильные поясничные боли, что, как позже выяснилось, было вызвано необратимыми поражениями почек;
сильными болями
в мышцах. Повсеместное распространение болезни и столь тяжелое ее протекание были вызваны высокой загрязненностью
окружающей среды
в Японии в то время и спецификой питания японцев (рис и морепродукты накапливают большое количество кадмия). Было установлено, что заболевшие странной болезнью употребляли порядка 600 мкг кадмия ежесуточно!
Несмотря на то, что кадмий признан одним из самых токсичных веществ, он нашел применение и в медицине! Так, введенная в грудную клетку пациента, страдающего сердечной недостаточностью, никель-кадмиевая батарейка обеспечивают энергией механический стимулятор работы сердца. Удобство такого аккумулятора заключается в том, что для его подзарядки или замены больному не придется ложиться на операционный стол. Для бесперебойной службы батарейки достаточно раз в неделю надевать всего на полтора часа специальную намагниченную куртку.
Кадмий применяется в гомеопатии, экспериментальной медицине, а совсем недавно его стали использовать при создании новых противоопухолевых препаратов.
Сплав Вуда (Wood»s metal), содержащий 50 % висмута, 12,5 % олова, 25 % свинца, 12,5 % кадмия, легко можно расплавить в кипящей воде. Сплав был изобретен в 1860 году не очень известным английским инженером Б.Вудом (B.Wood). С этим легкоплавким сплавом связано несколько любопытных фактов: во-первых, первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК, во-вторых, довольно часто изобретение ошибочно приписывают однофамильцу Б.Вуда — знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет.
Не так давно сорок восьмой элемент периодической системы поступил на «вооружение» Скотленд-ярда: с помощью тончайшего слоя кадмия, напыленного на обследуемую поверхность, удается быстро выявить четкие отпечатки пальцев преступника.
Учеными был установлен такой
интересный факт
: кадмированная жесть в атмосфере сельских местностей обладает значительно большей коррозийной устойчивостью, чем в атмосфере промышленных районов. Особенно быстро такое покрытие выходит из строя, если в воздухе повышено содержание сернистого или серного ангидридов.
В 1968 году один из сотрудников службы здравоохранения США (доктор Кэррол) обнаружил прямую связь между смертностью от сердечно-сосудистых заболеваний и содержанием кадмия в атмосфере. К таким выводам он пришел, проанализировав данные 28 городов. В четырех из них — Нью-Йорке, Чикаго, Филадельфии и Индианополисе — содержание кадмия в воздухе оказалось значительно выше, чем в остальных городах; более высокой была здесь и доля смертных случаев в результате болезней сердца.
Помимо «стандартных» мероприятий по ограничению выбросов кадмия в атмосферу, воду и почву (фильтра и очистители на предприятиях, удаление жилья и посевных полей от таких предприятий), ученые разрабатывают и новые — перспективные. Так американские ученые в бухте реки Миссисипи высадили водные гиацинты, полагая, что с их помощью удастся очистить воду от таких нежелательных элементов, как кадмий и ртуть.
История
Истории известно немало «открытий», которые были сделаны во время различных проверок, смотров и ревизий. Однако подобные находки имеют скорее криминальный характер, нежели научный. И все-таки был такой случай, когда начавшаяся ревизия в итоге привела к открытию нового химического элемента. Произошло это в Германии в начале XIX века. Окружной врач Р. Ролов проверял аптеки своего округа, в ходе ревизии — в ряде аптек вблизи Магдебурга — он обнаружил окись цинка, внешний вид которой вызывал подозрения и наводил на мысль о содержании в ней мышьяка. В подтверждение своих предположений Ролов растворил изъятый препарат в кислоте и пропустил через раствор сероводорода, что привело к выпадению желтого осадка, похожего на сульфид мышьяка. Немедленно были изъяты из продажи все подозрительные
лекарственные препараты
— мази, присыпки, эмульсии, порошки. Подобный шаг возмутил владельца фабрики в Шенебеке, производившей все забракованные Роловым препараты. Этот предприниматель — Герман, будучи по профессии химиком, провел собственную экспертизу товара. Испробовав весь известный в то время арсенал опытов по обнаружению мышьяка, он убедился в том, что его продукция чиста в этом отношении, а смутивший ревизора желтый цвет окиси цинка придает железо. Сообщив о результатах своих опытов Ролову и властям земли Ганновер, Герман потребовал независимой экспертизы и полной «реабилитации» своего товара. В результате было решено выяснить мнение профессора Штромейера, возглавлявшего кафедру химии Геттингенского университета, а по совместительству занимавшего пост генерального инспектора всех ганноверских аптек. Естественно, что Штромейеру на проверку отослали не только окись цинка, но и другие цинковые препараты с Шенебекской фабрики, в том числе карбонат цинка, из которого эту окись получали. Прокалив карбонат цинка ZnCO3, Фридрих Штромейер получил оксид, но не белый, как это должно было быть, а желтоватый. В результате дальнейших исследований, оказалось, что препараты не содержат ни мышьяка, как предполагал Ролов, ни железа, как думал Герман. Причиной необычной цветовой окраски был совершенно другой металл — ранее неизвестный и по свойствам весьма схожий с цинком. Различие было лишь в том, что гидроокись его, в отличие от Zn(OH)2, не была амфотерной, а имела ярко выраженные основные свойства. Штромейер назвал новый металл кадмием, намекая на сильную схожесть нового элемента с цинком — греческим словом καδμεια (kadmeia) издавна обозначали цинковые руды (например, смитсонит ZnCO3) и окись цинка. В свою очередь это слово происходит от имени финикийца Кадма, который, согласно преданиям, первым нашел цинковый камень и открыл его способность придавать меди (при выплавке ее из руды) золотистый цвет. Согласно
древнегреческим мифам
существовал и другой Кадм — герой, победивший Дракона и построивший на землях поверженного им врага крепость Кадмею, вокруг которой впоследствии вырос великий семивратный город Фивы. В семитских же языках «кадмос» означает «восточный», что, возможно, возводит название минерала от мест его добычи либо экспорта из какой-либо восточной страны или провинции.
В 1818 году Фридрих Штромейер опубликовал подробное описание нового металла, свойства которого он уже успел хорошо изучить. В свободном виде новый элемент представлял собой белый металл, мягкий и не очень прочный, сверху покрытый коричневатой пленкой окисла. Довольно скоро, как это часто бывает, приоритет Штромейера в открытии кадмия стали оспаривать, однако все претензии вскоре были отвергнуты. Несколько позже другой немецкий химик Керстен, нашел новый элемент в силезской цинковой руде и назвал его меллином (от латинского mellinus — «желтый, как айва»). Причиной такого названия послужил цвет осадка, образующегося под действием сероводорода. К огорчению Керстена «меллин» оказался «кадмием» Штромейера. Еще позже были предложены и другие названия сорок восьмому элементу: в 1821 году Джон предложил именовать новый элемент «клапротием» — в честь известного химика Мартина Клапрота — первооткрывателя урана, циркония и титана, а Гильберт «юнонием» — по имени открытого в 1804 году астероида Юноны. Но как бы ни были велики заслуги Клапрота перед наукой, его имени не суждено было закрепиться в списке химических элементов: кадмий остался кадмием. Правда, в русской химической литературе первой
половины XIX
века кадмий нередко называли кадмом.
Нахождение в природе
Кадмий типично редкий и довольно рассеянный элемент, среднее содержание данного металла в земной коре (кларк) оценивается примерно 1,3 10–5 % либо 1,6 10–5 % по массе, получается, что в литосфере кадмия приблизительно 130 мг/т. Кадмия настолько мало в недрах нашей планеты, что даже считающегося редким германия в 25 раз больше! Приблизительно такие же соотношения у кадмия и с другими редкими металлами: бериллием, цезием, скандием и индием. Кадмий близок по распространенности к сурьме (2 10–5 %) и в два раза более распространен, чем ртуть (8 10–6 %).
Для сорок восьмого элемента характерна миграция в горячих подземных водах вместе с цинком (кадмий содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка) и другими халькофильными элементами, то есть химическими элементами, склонными к образованию природных сульфидов, селенидов, теллуридов, сульфосолей и иногда встречающихся в самородном состоянии. Кроме того, сорок восьмой элемент концентрируется в гидротермальных отложениях. Довольно богаты кадмием вулканические породы, содержащие до 0,2 мг кадмия на кг; среди осадочных пород наиболее богаты сорок восьмым элементом глины — до 0,3 мг/кг (для сравнения известняки содержат кадмия 0,035 мг/кг, песчанники — 0,03 мг/кг). Среднее содержание кадмия в почве — 0,06 мг/кг. Также, этот редкий металл присутствует в воде — в растворенном виде (сульфат, хлорид, нитрат кадмия) и во взвешенном виде в составе органо-минеральных комплексов. В природных условиях сорок восьмой элемент попадает в
подземные воды
в результате выщелачивания руд цветных металлов, а также в результате разложения водных растений и организмов, способных его накапливать. С начала XX века преобладающим фактором поступления кадмия в воды и почву стало антропогенное загрязнение кадмием природных вод. На содержание кадмия в воде существенное влияние оказывает pH среды (в щелочной среде кадмий выпадает в осадок в виде гидроксида), а также сорбционные процессы. По той же антропогенной причине кадмий присутствует и в воздухе. В сельской местности содержание кадмия в воздухе составляет 0,1-5,0 нг/м3 (1 нг или 1 нанограмм = 10-9 грамм), в городах — 2-15 нг/м3, в промышленных районах — от 15 до 150 нг/м3. Главным образом попадание кадмия в атмосферный воздух связано с тем, что многие угли, сжигаемые на теплоэлектростанциях, содержат этот элемент. Осаждаясь из воздуха, кадмий попадает в воду и почву. Увеличению содержания кадмия в почве способствует использование минеральных удобрений, ведь практически все они содержат незначительные примеси этого металла. Из воды и почвы кадмий попадает в растения и живые организмы и далее по пищевой цепочке может «поставляться» человеку.
Кадмий имеет собственные минералы: хоулиит, отавит CdCO3, монтемпонит CdO (содержит 87,5 % Cd), гринокит CdS (77,8 % Cd), ксантохроит CdS(H2O)х (77,2 % Cd) кадмоселит CdSe (47 % Cd). Однако своих месторождений они не образуют, а присутствуют в виде примесей в цинковых, медных, свинцовых и полиметаллических рудах (более 50), которые и являются основным источником промышленной добычи сорок восьмого элемента. Причем
главную роль
играют руды цинка, где концентрация кадмия колеблется от 0,01 до 5 % (в сфалерите ZnS). В большинстве же случаев содержание кадмия в сфалерите не превышает 0,4 – 0,6 %. Кадмий накапливается также в галените (0,005 – 0,02 %), станните (0,003 – 0,2 %), пирите (до 0,02 %), халькопирите (0,006 – 0,12 %), однако из этих сульфидов кадмий обычно не извлекается.
Кадмий способен накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных), по этой причине кадмий можно обнаружить в морских осадочных породах — сланцах (Мансфельд, Германия). Общие мировые ресурсы кадмия оцениваются в 20 млн тонн, промышленные — в 600 тыс. тонн.
Применение
Главным потребителем сорок восьмого элемента является производство химических источников тока: никель-кадмиевые и серебряно-кадмиевые аккумуляторы, свинцово-кадмиевые и ртутно-кадмиевые элементы в резервных батареях, нормальные элементы Вестона. Применяемые в промышленности кадмийникелеве аккумуляторы (АКН) — одни из самых востребованных среди прочих химических источников тока. Отрицательные пластины подобных аккумуляторов выполнены из железных сеток с губчатым кадмием в качестве активного агента, а положительные пластины покрыты окисью никеля. В качестве электролита выступает раствор едкого кали (гидроксид калия). Никель-кадмиевые щелочные аккумуляторы более надежны, чем кислотные свинцовые. Химические источники тока, использующие кадмий отличаются продолжительным сроком эксплуатации, стабильностью работы и высокими
электрическими характеристиками
. Помимо всего прочего, подзарядка данных аккумуляторов занимает менее одного часа! Однако АКН нельзя подзаряжать без полной предварительной разрядки, и в этом они, конечно же, уступают металлогидридным аккумуляторам.
Другая широкая область применения кадмия — нанесение защитных антикоррозионных покрытий на металлы (кадмирование). Кадмиевое покрытие надежно предохраняет железные и стальные изделия от атмосферной коррозии. В прошлом кадмирование производили путем погружения металла в расплавленный кадмий, современный процесс осуществляют исключительно электролитическим путем. Кадмированию подвергают наиболее ответственные детали самолетов, кораблей, а также детали и механизмы, предназначенные для работы в условиях тропического климата. Известно, что некоторые свойства цинка и кадмия схожи, однако у кадмиевого покрытия есть определенные преимущества перед оцинкованным: во-первых, оно более устойчиво к коррозии, во-вторых, его легче сделать ровным и гладким. Кроме того, в отличие от цинка, кадмий устойчив в щелочной среде. Кадмированная жесть используется довольно широко, однако существует область, в которой применение покрытия из сорок восьмого элемента строго запрещено — это пищевая промышленность. Связано это с высокой токсичностью кадмия. До определенного момента распространение кадмиевых покрытий было ограничено и по другой причине — при электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород, а, как известно, этот элемент вызывает у высокопрочных сталей водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Проблему удалось решить советским ученым из Института
физической химии
Академии наук СССР. Оказалось, что ничтожная добавка титана (один атом титана на тысячу атомов кадмия) предохраняет кадмированную стальную деталь от возникновения водородной хрупкости, поскольку титан в процессе нанесения покрытия поглощает из стали весь водород.
Порядка десятой части мирового производства кадмия расходуется на производство сплавов. Небольшая температура плавления — одна из причин широкого применения кадмия в легкоплавких сплавах. Таковым, например, является сплав Вуда, содержащий 12,5 % сорок восьмого элемента. Подобные сплавы используют как припои, как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие сорок восьмой элемент, довольно устойчивы к температурным колебаниям. Другая отличительная черта кадмиевых сплавов — их высокие антифрикционные свойства. Так, сплав, содержащий 99 % кадмия и 1 % никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, подшипниковые сплавы на основе кадмия покрывают индием. Легирование меди малыми добавками кадмия (менее 1 %) позволяет делать более износостойкие провода на линиях электрического транспорта. Столь ничтожные добавки кадмия способны значительно повысить прочность и твердость меди, практически не ухудшая ее электрических свойств. Амальгаму кадмия (раствор кадмия в ртути) используют в зубоврачебной технике для изготовления зубных пломб.
В сороковые годы XX века у кадмия появилось новое амплуа — из него стали делать регулирующие и аварийные стержни атомных реакторов. Причина, по которой сорок восьмой элемент в кратчайший срок стал стратегическим материалом, заключалась в том, что он очень хорошо поглощает тепловые нейтроны. А ведь первые реакторы начала «атомного века» работали исключительно на тепловых нейтронах. Лишь позже выяснилось, что реакторы на быстрых нейтронах более перспективны и для энергетики, и для получения ядерного горючего — 239Pu, а против быстрых нейтронов кадмий бессилен, он их не задерживает. Однако еще во времена реакторов на тепловых нейтронах кадмий утратил главенствующую роль, уступив ее бору и его соединениям.
Порядка 20 % кадмия (в виде соединений) используется для производства неорганических красящих веществ. Сульфид кадмия CdS — важный минеральный краситель, ранее называвшийся кадмиевой желтью. Уже в начале XX века было известно, что можно получить кадмиевую желть шести оттенков, начиная от лимонно-желтого до оранжевого. Получаемые при этом краски устойчивы к слабым щелочам и кислотам, а к сероводороду совершенно не чувствительны. Краски на основе CdS использовались во многих областях — живописи, печати, росписи фарфора, ими покрывали пассажирские вагоны, защищая их от паровозного дыма. Красители, содержащие сульфид кадмия, использовали в текстильном и мыловаренном производствах. Однако в настоящее время довольно дорогой сульфид кадмия часто заменяют более дешевыми красителями — кадмопоном (смесь сульфида кадмия и сульфата бария) и цинко-кадмиевым литопоном (состав, как и у кадмопона, плюс сульфид цинка). Другое соединение сорок восьмого элемента — селенид кадмия CdSe — применяют как красную краску. Однако не только в производстве красящих веществ нашли свое применение соединения сорок восьмого элемента — сульфид кадмия, например, также применяется для производства плёночных солнечных батарей, коэффициент полезного действия которых составляет порядка 10-16 %. Кроме того, CdS — довольно хороший термоэлектрический материал, который используется как компонент полупроводниковых материалов и люминофоров. Иногда кадмий используют в криогенной технике, что связано с его максимальной теплопроводностью (относительно прочих металлов) вблизи абсолютного нуля.
Производство
Главные «поставщики» сорок восьмого элемента — это побочные продукты переработки цинковых, медно-цинковых и свинцово цинковых руд. Что же касается собственных минералов кадмия, то единственным, представляющим интерес в получении сорок восьмого элемента, является гринокит CdS, так называемая «кадмиевая обманка». Добывается гринокит совместно с фаеритом при разработке цинковых руд. В процессе переработки кадмий накапливается в побочных продуктах процесса, откуда его потом извлекают. При переработке полиметаллических руд, как говорилось ранее, кадмий является побочным продуктом цинкового производства. Это либо медно-кадмиевые кеки (осадки металлов, полученные вследствие очистки растворов сульфата цинка ZnSO4 действием цинковой пыли), которые содержат от 2 до 12 % Cd, либо пуссьеры (летучие фракции, образующиеся при дистилляционном получении цинка), содержащие от 0,7 до 1,1 % кадмия. Наиболее богаты сорок восьмым элементом концентраты, полученные при ректификационной очистке цинка, они могут содержать до 40 % кадмия. Из медно-кадмиевых кеков и других продуктов с высоким содержанием сорок восьмого элемента его обычно выщелачивают серной кислотой H2SO4 при одновременной аэрации воздухом. Процесс ведут в присутствии окислителя — марганцевой руды или оборотного марганцевого шлама из электролизных ванн.
Кроме того, кадмий извлекается из пыли свинцовых и медеплавильных заводов (она может содержать от 0,5 до 5% и от 0,2 до 0,5 % кадмия, соответственно). В таких случаях пыль обычно обрабатывают концентрированной серной кислотой H2SO4, а затем получившийся сульфат кадмия выщелачивают водой. Из полученного раствора сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, после чего ее растворяют в серной кислоте и очищают раствор от примесей действием карбоната натрия Na2CO3 или оксида цинка ZnO, возможно также использование методов ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах или же восстановлением цинком (вытеснением цинком оксида кадмия CdO из растворов CdSO4) с применением центробежных реакторов-сепараторов. Рафинирование металлического кадмия обычно заключается в переплавке металла под слоем щелочи (для удаления цинка и свинца), при этом возможно использование Na2CO3; обработке расплава алюминием (для удаления никеля) и хлоридом аммония NH4Cl (для удаления таллия). Кадмий более высокой чистоты получают электролитическим рафинированием с промежуточной очисткой электролита, которая проводится с применением ионного обмена или экстракцией; ректификацией металла (обычно при пониженном давлении), зонной плавкой или другими кристаллизационными методами. Сочетая выше приведенные способы очистки, возможно получение металлического кадмия с содержанием основных примесей (цинк, медь и прочие) всего 10-5 % по массе. Кроме того, для очистки сорок восьмого элемента могут быть использованы методы электропереноса в жидком кадмии, электрорафинирования в расплаве гидроксида натрия NaOH, амальгамного электролиза. При сочетании зонной плавки с электропереносом наряду с очисткой может происходить и разделение изотопов кадмия.
Мировой объем производства кадмия в значительной степени связан с масштабами производства цинка и за последние десятилетия значительно возрос — по данным 2006 года в мире производилось порядка 21 тысячи тонн кадмия, в то время как в 1980 году эта цифра составляла всего 15 тысяч тонн. Рост потребления сорок восьмого элемента продолжается и сейчас. Основными производителями данного металла считаются страны Азии: Китай, Япония, Корея, Казахстан. На их долю приходится 12 тысяч тонн от общего производства. Крупными производителями кадмия также можно считать Россию, Канаду и Мексику. Смещение массового производства кадмия в сторону Азии связано с тем, что в Европе произошло сокращение использования сорок восьмого элемента, а в Азиатском регионе наоборот — растет спрос на никель-кадмиевые элементы, что заставляет многих переводить производство в страны Азии.
Физические свойства
Кадмий — серебристо-белый металл, отливающий синевой на свежем срезе, однако тускнеющий на воздухе из-за образования защитной окисной пленки. Кадмий довольно мягкий металл — он тверже олова, но мягче цинка, его вполне возможно разрезать ножом. В совокупности с мягкостью сорок восьмой элемент обладает такими важными для промышленности качествами, как ковкость и тягучесть — он отлично прокатывается в листы и протягивается в проволоку, без особых проблем поддается полировке. При нагреве выше 80 °C кадмий теряет свою упругость, причем настолько, что его легко можно истолочь в порошок. Твердость кадмия по Моосу равна двум, по Бринеллю (для отожженного образца) 200-275 МПа. Предел прочности при растяжении 64 Мн/м2 или 6,4 кгс/мм2, относительное удлинение 50 % (при температуре 20 °C), предел текучести 9,8 МПа.
Кадмий имеет гексагональную плотноупакованную кристаллическую решетку с периодами: а = 0,296 нм, с = 0,563 нм, отношение с/а = 1,882, z = 2, энергия кристаллической решетки 116 мкДж/кмоль. Пространственная группа С6/mmm, атомный радиус 0,156 нм, ионный радиус Cd2+ 0,099 нм, атомный объем 13,01∙10-6 м3/моль. Пруток из чистого кадмия при изгибании издает слабый треск подобно олову («оловянный крик») — это трутся друг о друга микрокристаллы металла, однако любые примеси в металле уничтожают этот эффект. Вообще по своим физическим, химическим и фармакологическим свойствам кадмий принадлежит к группе тяжелых металлов, имея более всего сходства с цинком и ртутью.
Температура плавления сорок восьмого элемента (321,1 °С) довольно низка и может быть сравнима с температурами плавления свинца (327,4 °С) или таллия (303,6 °С). Однако она отличается от температур плавления схожих по ряду свойств металлов — ниже, чем у цинка (419,5 °С), но выше, чем у олова (231,9 °С). Температура кипения кадмия тоже невысока — всего 770 °С, что довольно интересно — у свинца, как и у большинства других металлов разница между температурами плавления и кипения большая. Так у свинца температура кипения (1 745 °С) больше температуры плавления в 5 раз, а у олова, температура кипения которого 2 620 °С, в 11 раз больше температуры плавления! В тоже время, сходный с кадмием цинк имеет при температуре плавления в 419,5° С температуру кипения всего 960 °С. Коэффициент термического расширения для кадмия равен 29,8 10-6 (при температуре 25 °C). Ниже 0,519 К кадмий становится сверхпроводником. Теплопроводность сорок восьмого элемента при 0 °C составляет 97,55 вт/(м К) или 0,233 кал/(см сек °С). Удельная теплоемкость кадмия (при температуре 25 °C) равна 225,02 дж/(кг К) или 0,055 кал/(г °С). Температурный коэффициент электросопротивления сорок восьмого элемента в температурном интервале от 0 °С до 100 °С равен 4,3 10-3, удельное электросопротивление сорок восьмого элемента (при температуре 20 °C) составляет 7,4 10-8 ом м (7,4 10-6 ом см). Кадмий диамагнитен, его магнитная восприимчивость -0,176,10-9 (при температуре 20 °С). Стандартный электродный потенциал -0,403 В. Электроотрицательность кадмия 1,7. Эффективное поперечное сечение захвата тепловых нейтронов 2450- 2900-10 ~ 28 м2. Работа выхода электронов = 4,1 эВ.
Плотность (при комнатной температуре) сорок восьмого элемента 8,65 г/см3, что позволяет отнести кадмий к тяжелым металлам. По классификации Н.Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3. Таким образом, к тяжелым металлам относятся Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg. И хотя кадмий легче свинца (плотность 11,34 г/см3) или ртути (13,546 г/см3), но тяжелее олова (7,31 г/см3).
Химические свойства
В
химических соединениях
кадмий всегда проявляет валентность 2 (конфигурация внешнего электронного слоя 5s2) — дело в том, что у атомов элементов побочной подгруппы второй группы (цинк, кадмий, ртуть), как и у атомов элементов подгруппы меди, d-подуровень второго снаружи электронного слоя целиком заполнен. Однако у элементов подгруппы цинка этот подуровень уже вполне стабилен и удаление из него электронов требует очень большой затраты энергии. Другой характерной особенностью элементов подгруппы цинка, сближающей их с элементами подгруппы меди, является их склонность к комплексообразованию.
Как уже говорилось сорок восьмой элемент расположен в одной группе периодической системы с цинком и ртутью, занимая промежуточное место между ними, по этой причине ряд химических свойств всех этих элементов сходен. Например, оксиды и сульфиды данных металлов практически нерастворимы в воде.
В сухом воздухе кадмий устойчив, но во влажном на поверхности металла медленно образуется тонкая пленка оксида CdO, предохраняющая металл от дальнейшего окисления. При сильном накаливании кадмий сгорает, также превращаясь в оксид кадмия — кристаллический порошок от светло-коричневого до темно-бурого цвета (различие в цветовой гамме частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки), плотность CdO 8,15 г/см3; выше 900 °С оксид кадмия летуч, а при 1 570 °С полностью возгоняется. Пары кадмия реагируют с парами воды с выделением водорода.
Кислоты взаимодействуют с кадмием с образованием солей этого металла. Азотная кислота HNO3 легко растворяет сорок восьмой элемент, при этом выделяется оксид азота и образуется нитрат, который дает гидрат Cd(NO3)2 4H2O. Из других кислот — соляной и разбавленной серной — кадмий медленно вытесняет водород, объясняется это тем, что в ряду напряжений сорок восьмой элемент стоит дальше цинка, но впереди водорода. С растворами щелочей, в отличие от цинка, кадмий не взаимодействует. Кадмий восстанавливает нитрат аммония NH4NO3 в концентрированных растворах до нитрита аммония NH4NO2. Выше температуры плавления кадмий непосредственно соединяется с галогенами, образуя бесцветные соединения — кадмия галогениды. CdCl2, CdBr2 и CdI2 очень легко растворяются в воде (53,2 % по массе при 20 °С), гораздо труднее растворим фторид кадмия CdF2 (4,06 % по массе при 20 °С), который совершенно не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия. Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500 °С. Бромид кадмия получают бромированием металла или действием бромоводорода на карбонат кадмия. При нагревании кадмий взаимодействует с серой, образуя сульфид CdS (от лимонно-желтого до оранжево-красного цвета), нерастворимый в воде и разбавленных кислотах. При сплавлении кадмия с фосфором и мышьяком образуются соответственно фосфиды и арсениды составов Cd3P2 и CdAs2, с сурьмой — кадмия антимонид. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует. Косвенными путями получены легко разлагающиеся при нагревании гидрид CdH2 и нитрид Cd3N2.
Растворы солей кадмия имеют кислую реакцию вследствие гидролиза, едкие щелочи осаждают из них белый гидрооксид Cd(OH)2. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие, как Na2. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Cd(OH)2 + 6NH3 H2O → (OH)2 + 6H2O
Кроме того, Cd(OH)2 переходит в раствор под действием цианидов щелочных элементов. Выше 170 °С он разлагается до CdO. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Кадмий — мягкий, ковкий, но тяжелый металл серо-серебристого цвета, простой элемент периодической таблицы Менделеева. Содержание его в земной коре высоким не назовешь, но кадмий относится к рассеянным элементам: он встречается в почве, морской воде и даже в воздухе (особенно в городах). , как правило, сопутствует цинковым минералам, хотя существуют и кадмиевые минералы. Промышленного значения, впрочем, большинство из них не имеет. Кадмий не образует отдельных месторождений и выделяется из отработанных руд после того, как из них выплавлены цинк, свинец или медь.
Свойства кадмия
Кадмий хорошо обрабатывается, вальцуется и полируется. В сухом воздухе кадмий с кислородом реагирует (горит) лишь при
высоких температур
ах. Реагирует с неорганическими кислотами с образованием солей. С растворами щелочей не реагирует. В расплавленном состоянии вступает в реакции с галогенами, серой, теллуром, селеном, кислородом.
— Несмотря на то, что кадмий в микроколичествах присутствует во всех живых организмах и участвует в их обмене веществ, его пары и пары его соединений крайне ядовиты. Например, концентрация 2,5 г/куб. м оксида кадмия в воздухе убивает уже через 1 минуту. Очень опасно вдыхание воздуха с пылью или дымом, содержащими кадмий,
— Кадмий обладает способностью накапливаться в организме человека, в растениях, грибах. Кроме этого, соединения кадмия являются канцерогенами.
— Кадмий считается одним из самых опасных тяжелых металлов, он отнесен к веществам 2-го класса опасности, так же как ртуть и мышьяк. Он отрицательно влияет на ферментную, гормональную, кровеносную и центральную нервную систему, нарушает фосфорно-кальциевый обмен (разрушает кости), поэтому при работе с ним надо использовать средства химической защиты . При отравлении кадмием требуется срочная медицинская помощь.
Применение
Большая часть добываемого кадмия применяется для производства покрытий против коррозии. Кадмиевое покрытие создает более прочное и пластичное сцепление с деталью, чем все другие, поэтому кадмирование применяется для защиты от коррозии в особо сложных условиях, например, при контакте с
морской водой
, для защиты электроконтактов.
— Весьма востребован при изготовлении аккумуляторов и батарей.
— Используется как реактив для лабораторных исследований.
— Почти пятая часть получаемого вещества идет на изготовление пигментов — солей кадмия.
— Применяется для придания сплавам нужных свойств. Сплавы с кадмием бывают легкоплавкими (со свинцом, оловом, висмутом), пластичными, и тугоплавкими (с никелем, медью, цирконием), износостойкими. Из сплавов производят провода для ЛЭП, твердые припои для алюминия, подшипники для больших и мощных двигателей (судовых, авиационных). Легкоплавкие сплавы используют для изготовления гипсовых отливок, пайки стекла и металла, в некоторых огнетушителях.
— Очень важная сфера применения —
атомная промышленность
. Из кадмия производят стержни для регулирования скорости атомной реакции в реакторе, а также защитные экраны от нейтронного излучения.
— Входит в состав полупроводников, пленочных солнечных батарей, люминофоров, стабилизаторов для ПВХ, зубных пломб.
— Сплавы с золотом применяются в ювелирном деле. Варьируя соотношение золота и кадмия, можно получить сплавы разных оттенков, от желтого до зеленоватого.
— Иногда применяют в криотехнике из-за высокой теплопроводности при очень низких температурах.
— Кадмий способен накапливаться в раковых клетках, поэтому используется в некоторых методиках противоопухолевой терапии.
В магазине «ПраймКемикалсГрупп» продаются средства химической защиты, хим реактивы для лабораторных исследований, посуда и приборы для оборудования лабораторий и проведения исследований. Покупателей порадуют демократичные цены, доставка по Москве и области, отличный сервис.
В 1968 г. в одном известном журнале появилась заметка, которая называлась «Кадмий и сердце». В ней говорилось, что доктор Кэррол — сотрудник службы здравоохранения США — обнаружил зависимость между содержанием кадмия в атмосфере и частотой
смертельных случаев
от сердечно-сосудистых заболеваний. Если, скажем, в городе А содержание кадмия в воздухе больше, чем в городе Б, то и сердечники города А умирают раньше, чем если бы они жили в городе Б. Такой вывод Кэррол сделал, проанализировав данные по 28 городам. Между прочим, в группе А оказались такие центры, как Нью-Йорк, Чикаго, Филадельфия…
Так в очередной раз предъявили обвинение в отравительстве элементу, открытому в аптечной склянке!
Элемент из аптечной склянки
Вряд ли кто-либо из магдебургских аптекарей произносил знаменитую фразу городничего: «Я пригласил вас, господа, с тем, чтобы сообщить вам пренеприятное известие»,- но общая с ним черта у них была: ревизора они боялись.
Окружной врач Ролов отличался крутым нравом. Так, в 1817 г. он приказал изъять из продажи все препараты с окисью цинка , вырабатываемой на шенебекской фабрике Германа. По
внешнему виду
препаратов он заподозрил, что в окиси цинка есть мышьяк! (Окись цинка до сих пор применяют при кожных заболеваниях; из нее делают мази, присыпки, эмульсии.)
Чтобы доказать свою правоту, строгий ревизор растворил заподозренный окисел в кислоте и через этот раствор пропустил сероводород: выпал желтый осадок. Сульфиды мышьяка как раз желтые!
Владелец фабрики стал оспаривать решение Ролова. Он сам был химиком и, собственноручно проанализировав Образцы продукции, никакого мышьяка в них не обнаружил. Результаты анализа он сообщил Ролову, а заодно и властям земли Ганновер. Власти, естественно, затребовали образцы, чтобы отправить их на анализ кому-либо из авторитетных химиков. Решили, что судьей в споре Ролова и Германа должен выступить профессор Фридрих Штромейер, занимавший с 1802 г. кафедру химии в Геттингенском университете и должность генерального инспектора всех ганноверских аптек.
Штромейеру послали не только окись цинка, но и другие цинковые препараты с фабрики Германа, в том числе ZnC0 3 , из которого эту окись получали. Прокалив углекислый цинк, Штромейер получил окись, но не белую, как это должно было быть, а желтоватую. Владелец фабрики объяснял окраску примесью железа , но Штромейера такое объяснение не удовлетворило. Закупив побольше цинковых препаратов, он произвел полный их анализ и без особого труда выделил элемент, который вызывал пожелтение. Анализ говорил, что это не мышьяк (как утверждал Ролов), но и не железо (как утверждал Герман).
Фридрих Штромейер (1776-1835)
Это был новый, неизвестный прежде металл, по химическим свойствам очень похожий на цинк. Только гидроокись его, в отличие от Zn(OH) 2 , не была амфотерной, а имела ярко выраженные основные свойства.
В свободном виде новый элемент представлял собой белый металл, мягкий и не очень прочный, сверху покрытый коричневатой пленкой окисла. Металл этот Штромейер назвал кадмием, явно намекая на его «цинковое» происхождение: греческим словом издавна обозначали цинковые руды и окись цинка.
В 1818 г. Штромейер опубликовал подробные сведения о новом химическом элементе, и почти сразу на его приоритет стали покушаться. Первым выступил все тот же Ролов, который прежде считал, что в препаратах с фабрики Германа есть мышьяк . Вскоре после Штромейера другой немецкий химик, Керстен, нашел новый элемент в силезской цинковой руде и назвал его меллином (от латинского mellinus — «желтый, как айва») из-за цвета осадка, образующегося под действием сероводорода. Но это был уже открытый Штромейером
кадмий. Позже этому элементу предлагали еще два названия: клапротий — в честь известного химика Мартина Клапрота и юноний — по имени открытого в 1804 г. астероида Юноны. Но утвердилось все- таки название, данное элементу его первооткрывателем. Правда, в русской химической литературе первой половины XIX в. кадмий нередко называли кадмом.
Семь цветов радуги
Сульфид кадмия CdS был, вероятно, первым соединением элемента № 48, которым заинтересовалась промышленность. CdS — это кубические или гексагональные кристаллы плотностью 4,8 г/см 3 . Цвет их от светло-желтого до оранжево-красного (в зависимости от способа приготовления). В воде этот сульфид практически не растворяется, к действию растворов щелочей и большинства кислот он тоже устойчив. А получить CdS довольно просто: достаточно пропустить, как это делали Штромейер и Ролов, сероводород через подкисленный раствор, содержащий ионы Cd 2+ . Можно получать его и в обменной реакции между растворимой солью кадмия, например CdS0 4 , и любым растворимым сульфидом.
CdS — важный минеральный краситель. Раньше его называли кадмиевой желтью. Вот что писали про кадмиевую желть в первой русской «Технической энциклопедии», выпущенной в начале XX в.
«Светлые желтые тона, начиная с лимонно-желтого, получаются из чистых слабокислых и нейтральных растворов сернокислого кадмия, а при осаждении сульфида кадмия раствором сернистого натрия получают тона более темно-желтые. Немалую роль при производстве кадмиевой желти играет присутствие в растворе примесей других металлов, как, например, цинка. Если последний находится совместно с кадмием в растворе, то при осаждении получается краска мутно-желтого тона с белесоватым оттенком… Тем или иным способом можно получить кадмиевую желть шести оттенков, начиная от лимонножелтого до оранжевого… Краска эта в готовом виде имеет очень красивый блестящий желтый цвет. Она довольно постоянна к слабым щелочам и кислотам, а к сероводороду совершенно не чувствительна; поэтому она смешивается в сухом виде с ультрамарином и дает прекрасную зеленую краску, которая в торговле называется кадмиевой зеленью.
Будучи смешана с олифою, она идет как
масляная краска
в малярном деле; очень укрывиста, но из-за высокой рыночной цены потребляется главным образом в живописи как масляная или акварельная краска, а также и для печатания. Благодаря ее большой огнеупорности употребляется для живописи по фарфору».
Остается добавить только, что впоследствии кадмиевая желть стала шире применяться «в малярном деле». В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия применили также в текстильном и мыловаренном производствах.
Но в последние годы промышленность все реже использует чистый сульфид кадмия — он все-таки дорог. Вытесняют его более дешевые вещества — кадмопон и цинкокадмиевый литопон.
Реакция получения кадмопона — классический пример образования двух осадков одновременно, когда в растворе не остается практически ничего, кроме воды:
CdSO 4 4- BaS (обе соли растворимы в воде) _*CdS J + BaS04 J .
Кадмопон — смесь сульфида кадмия и сульфата бария. Количественный состав этой смеси зависит от концентрации растворов. Варьировать состав, а следовательно, и оттенок красителя просто.
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Цвет литопона кремовый или слоновой кости.
Как мы уже убедились, вещи осязаемые можно с помощью сульфида кадмия окрасить в три цвета: оранжевый, зеленый (кадмиевая зелень) и все оттенки желтого, д вот пламени сульфид кадмия придает иную окраску — синюю. Это его свойство используют в пиротехнике.
Итак, с помощью одного лишь соединения элемента 48 можно получить четыре из семи цветов радуги. Остаются лишь красный, голубой и фиолетовый. К голубому или
фиолетовому цвету
пламени можно прийти, дополняя свечение сернистого кадмия теми или иными пиротехническими добавками — для опытного пиротехника особого труда это не составит.
А красную окраску можно получить с помощью другого соединения элемента № 48 — его селенида. CdSe используют в качестве художественной краски, кстати очень ценной. Селенидом кадмия окрашивают рубиновое стекло; и не окись хрома, как в самом рубине, а селенид кадмия сделал рубиново-красными звезды московского Кремля.
Тем не менее значение солей кадмия намного
меньше значения
самого металла.
Преувеличения портят репутацию
Если построить диаграмму, отложив по горизонтальной оси даты, а по вертикальной — спрос на кадмий, то получится восходящая кривая. Производство этого элемента растет, и самый резкий «скачок» приходится на 40-е годы нашего столетия. Именно в это время кадмий превратился в стратегический материал — из него стали делать регулирующие и аварийные стержни атомных реакторов.
В популярной литературе можно встретить утверждение, что если бы не эти стержни, поглощающие избыток нейтронов, то реактор пошел бы «вразнос» и превратился в атомную бомбу. Это не совсем так. Для того чтобы произошел атомный взрыв, нужно соблюдение многих условий (здесь не место говорить о них подробно, а коротко ЭТ0 не объяснишь). Реактор, в котором
цепная реакция
стала неуправляемой, вовсе не обязательно взрывается, Но в любом случае происходит серьезная авария, чреватая огромными материальными издержками. А иногда не только материальными… Так что роль регулирующих и;икРииных стержней и без преувеличений достаточно вс-
Столь же не точно утверждение (см., например, известную книгу II. Р. Таубе и Е. И. Руденко «От водорода до… ». М., 1970), что для изготовления стержней и регулировки потока нейтронов кадмий — самый подходящий материал. Если бы перед словом «нейтронов» было еще и «тепловых», вот тогда это утверждение стало бы действительно точным.
Нейтроны, как известно, могут сильно отличаться по энергии. Есть нейтроны низких энергий — их энергия не превышает 10 килоэлектронвольт (кэв). Есть быстрые нейтроны — с энергией больше 100 кэв. И есть, напротив, малоэнергичные — тепловые и «холодные» нейтроны. Энергия первых измеряется сотыми долями электронвольта, у вторых она меньше 0,005 эв.
Кадмий на первых порах оказался главным «стержневым» материалом прежде всего потому, что он хорошо поглощает тепловые нейтроны. Все реакторы начала «атомного века» (а первый из них был построен Энрнко Ферми в 1942 г.) работали на тепловых нейтронах. Лишь спустя много лет выяснилось, что реакторы на быстрых нейтронах более перспективны и для энергетики, и для получения ядерного горючего — плутония-239. А против быстрых нейтронов кадмий бессилен, он их не задерживает.
Поэтому не следует преувеличивать роль кадмия в реакторостроении. А еще потому, что физико-химические свойства этого металла (прочность, твердость, термостойкость — его температура плавления всего 321° С) оставляют желать лучшего. А еще потому, что и без преувеличений роль, которую кадмий играл и играет в атомной технике, достаточно значима.
Кадмий был первым стержневым материалом. Затем на первые роли стали выдвигаться бор и его соединения. Но кадмий легче получать в больших количествах, чем бор: кадмий получали и получают как побочный продукт производства цинка и свинца. При переработке полиметаллических руд он — аналог цинка — неизменно оказывается главным образом в цинковом концентрате. А восстанавливается кадмий еще легче, чем цинк, и температуру кипения имеет меньшую (767 и 906°С соответственно). Поэтому при температуре около 800° С нетрудно разделить цинк и кадмий.
Кадмий мягок, ковок, легко поддается механической об-работке. Это тоже облегчало и ускоряло его путь в атомную технику. Высокая избирательная способность кад- }1ИЯ, его чувствительность именно к тепловым нейтронам также были на руку физикам. А по основной рабочей характеристике — сечению захвата тепловых нейтронов — кадмий занимает одно из первых мест среди всех элементов периодической системы — 2400 барн. (Напомним, что сечение захвата — это способность «вбирать в себя» нейтроны, измеряемая в условных единицах барнах.)
Природный кадмий состоит из восьми изотопов (с массовыми числами 106, 108, 110, 111, 112, ИЗ, 114 и 116), а сечение захвата — характеристика, по которой изотопы одного элемента могут отличаться очень сильно. В природной смеси изотопов кадмия главный «нейтроноглотатель»-это изотоп с массовым числом ИЗ. Его индивидуальное сечение захвата огромно — 25 тыс. барн!
Присоединяя нейтрон, кадмий-113 превращается в самый распространенный (28,86% природной смеси) изотоп элемента № 48 — кадмий-114. Доля же самого кадмия-113 — всего 12,26%.
Регулирующие стержни атомного реактора.
К сожалению, разделить восемь изотопов кадмия намного сложнее, чем два изотопа бора.
Регулирующие и аварийные стержни не единственное место «атомной службы» элемента № 48. Его способность поглощать нейтроны строго определенных энергий помогает исследовать энергетические спектры полученных нейтронных пучков. С помощью кадмиевой пластинки, которую ставят на пути пучка нейтронов, определяют, насколько этот пучок однороден (по величинам энергии), какова в нем доля тепловых нейтронов и т. д.
Не много, но есть
И напоследок — о ресурсах кадмия. Собственных его минералов, как говорится, раз-два и обчелся. Достаточно полно изучен лишь один — редкий, не образующий скоплений гринокит CdS. Еще два минерала элемента № 48 — отавит CdCO 3 и монтепонит CdO — совсем уж редки. Но не собственными минералами «жив» кадмий. Минералы цинка и полиметаллические руды — достаточно надежная
сырьевая база
для его производства.
Кадмирование
Всем известна оцинкованная жесть, но далеко не все знают, что для предохранения ягелеза от коррозии применяют не только цинкование, но и кадмирование. Кадмиевое покрытие сейчас наносят только электролитически, чаще всего в промышленных условиях применяют цианидные ванны. Раньше кадмировали железо и другие металлы погружением изделий в расплавленный кадмий.
Несмотря на сходство свойств кадмия и цинка, у кадмиевого покрытия есть несколько преимуществ: оно более устойчиво к коррозии, его легче сделать ровным и гладким. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде. Кадмированную жесть применяют довольно широко, закрыт ей доступ только в производство тары для
пищевых продуктов
, потому что кадмий токсичен. У кадмиевых покрытий есть еще одна любопытная осо-бенность: в атмосфере сельских местностей они обладают значительно большей коррозийной устойчивостью, чем в атмосфере промышленных районов. Особенно быстро такое покрытие выходит из строя, если в воздухе повышено содержание сернистого или серного ангидридов.
Кадмий в сплавах
На производство сплавов расходуется примерно десятая часть мирового производства кадмия. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Известный сплав состава 99% Cd и 1% № применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку
кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Припои, содержащие элемент № 48, довольно устойчивы к температурным колебаниям.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкие провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но зато заметно превосходит ее прочностью и твердостью.
АККУМУЛЯТОР АКН И НОРМАЛЬНЫЙ ЭЛЕМЕНТ ВЕСТОНА.
Среди применяемых в промышленности химических источников тока заметное место принадлежит кадмийникелевым аккумуляторам (АКН). Отрицательные пластины таких аккумуляторов сделаны из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты окисью никеля. Электролитом служит раствор едкого кали. Кадмийникелевые щелочные аккумуляторы отличаются от свинцовых (кислотных) большей надежностью. На основе этой,пары делают и очень компактные аккумуляторы для управляемых ракет. Только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Элемент № 48 и его соединения использованы еще в одном
химическом источнике
тока. В конструкции нормального элемента Вестона работают и амальгама кадмия, и кристаллы сульфата кадмия, и раствор этой соли.
Токсичность кадмия
Сведения о токсичности кадмия довольно противоречивы. Вернее, то, что кадмий ядовит, бесспорно: спорят ученые о степени опасности кадмия. Известны случаи смертельного отравления парами этого металла и его соединении — так что такие пары представляют серьезную опасность. При попадании в желудок кадмий тоже вреден, но случаи смертельного отравления соединениями кадмия, попавшими в организм пищей, науке неизвестны. Видимо, это объясняется немедленньм удалением яда из желудка, предпринимаемым самим организмом. ] ем не менее во многих странах применение кадмированных покрытий для изготовления пищевой тары запрещено законом.
ОПРЕДЕЛЕНИЕ
Кадмийрасположен в пятом периоде II группе побочной (В) подгруппе Периодической таблицы.
Относится к элементам
d-семейства. Металл. Обозначение — Cd. Порядковый номер — 48. Относительная атомная масса — 112,41 а.е.м.
Электронное строение атома кадмия
Атом кадмия состоит из положительно заряженного ядра (+48), внутри которого есть 48 протонов и 64 нейтрона, а вокруг, по пяти орбитам движутся 48 электронов.
Рис.1. Схематическое строение атома кадмия.
Распределение электронов по орбиталям выглядит следующим образом:
48Cd) 2) 8) 18) 18) 2 ;
1
s2 2
s2 2
p6 3
s2 3
p6 3
d10 4
s2 4
p6 4
d10 5
s2 .
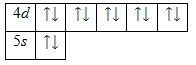
Валентными электронами атома кадмия считаются электроны, расположенные на 4
d— и 5
s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома кадмия можно охарактеризовать набором из четырех квантовых чисел:
n(главное квантовое),
l(орбитальное),
m l(магнитное) и
s(спиновое):
|
Подуровень |
||||
Примеры решения задач
ПРИМЕР 1
| Задание | Сколько атомных орбиталей p-подуровня заполнено у элементов с порядковыми номерами 35 и 54? Запишите их электронные формулы. |
| Ответ | Элементы с порядковыми номерами 35 и 54 — это бром и ксенон. Запишем их электронный формулы в основном состоянии:
35 Br1 54 Xe1 На р-подуровне имеется 3 орбитали, на каждой из которых может располагаться не более 2-х электронов (6 в сумме). У атомов брома и ксенона p-орбитали заполнены. |
ПРИМЕР 2
| Задание | Какие значения могут принимать квантовые числа n, l, m lи m s, характеризующие состояние электронов в атоме. Какие значения они принимают для внешних электронов атома кальция? |
|||||||||||||||
| Ответ | Главное квантовое число n может принимать значения от 1 и до бесконечности, но в реальности его пределом является число 7. Орбитальное квантовое число l может принимать значения от 0 до 3. Магнитное квантовое число m lпринимает значения от -l через 0 до +l. У спинового квантового числа m sможет быть всего два значения: +1/2 и -1/2. Запишем электронную конфигурацию основного состояния атома магния (валентные электроны выделим жирным шрифтом): 1 Электроны внешнего энергетического уровня будут характеризоваться следующим набором квантовых чисел:
|
Возможно, будет полезно почитать:
- Заявление о приостановке работы в связи с невыплатой зарплаты
; - Что сказано об увольнении по собственному желанию в п
; - Как восстановить утерянную квитанцию Потерял чек сбербанка можно ли восстановить
; - Где взять номер лицевого счета для заявления на налоговый вычет?
; - Порядок заполнения перечня заявлений о ввозе товаров и уплате косвенных налогов Проверить уплату косвенных налогов в белоруссии
; - Поиск инн организации по названию
; - Дистанционное обучение на бухгалтерских курсах
; - Измерение величин Измеряется s в физике
;
Частые вопросы
Как кадмий влияет на организм человека?
Хроническое воздействие кадмия может привести к остеомаляции, нарушению минерализации костей, сопровождающемуся переломами и деформацией костей. Избыточное поступление кадмия в организм может приводить к анемии, поражению печени, кардиопатии, развитию гипертонии.
Какие болезни вызывает кадмий?
Острое отравление парами кадмия приводит к пневмонии, отеку легких, а хроническое – к легочному фиброзу. При избыточном поступлении кадмия в желудочно-кишечный тракт интоксикация протекает по типу тяжелого гастроэнтерита, развивается тошнота, рвота, слюнотечение, спастические боли в животе, диарея.
Где накапливается кадмий в организме человека?
В организме человека кадмий аккумулируется в основном в почках, печени и двенадцатиперстной кишке. С возрастом содержание кадмия в организме увеличивается, особенно у мужчин. Кадмий выводится из организма преимущественно через кишечник.
Сколько кадмия в организме человека?
Кадмий аккумулируется в тканях и органах — печени, почках, в организме новорождённых он отсутствует. В крови более 95% кадмия находится в эритроцитах. Повышенная концентрация кадмия в крови указывает на острое или хроническое отравление. В организм взрослого человека в течение суток поступает 10–20 мкг кадмия.
Полезные советы
СОВЕТ №1
При работе с кадмием используйте защитное снаряжение, такое как маска, перчатки и защитные очки, чтобы избежать вдыхания или попадания вещества на кожу.
СОВЕТ №2
Приобретайте кадмий у надежных поставщиков, убедившись в качестве продукции и соблюдении всех стандартов безопасности.