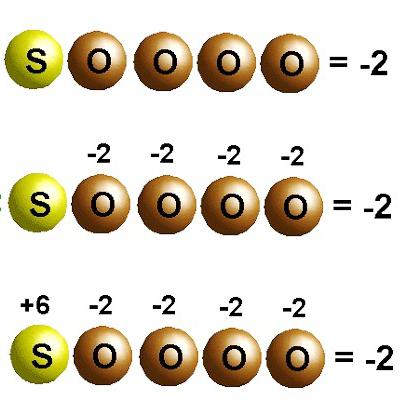Такой предмет
школьной программы
как химия вызывает многочисленные затруднения у большинства современных школьников, мало кто может определить степень окисления в соединениях. Наибольшие сложности у школьников, которые изучают неорганическую химию, то есть учеников основной школы (8-9 классы). Непонимание предмета приводит к возникновению неприязни у школьников к данному предмету.
Педагоги выделяют целый ряд причин такой «нелюбви» учеников средних и старших классов к химии: нежелание разбираться в сложных химических терминах, неумение пользоваться алгоритмами для рассмотрения конкретного процесса, проблемы с математическими знаниями. Министерством образования РФ были внесены серьезные изменение в содержание предмета. К тому же «урезали» и количество часов на преподавание химии. Это негативно сказалось на качестве знаний по предмету, снижению интереса к изучению дисциплины.
Какие темы курса химии даются школьникам труднее всего?
По
новой программе
в курс учебной дисциплины «Химия» основной школы включено несколько серьезных тем: периодическая таблица элементов Д. И. Менделеева, классы неорганических веществ,
ионный обмен
. Труднее всего дается восьмиклассникам определение оксидов.
Мнение эксперта:
Степень окисления элемента вещества — это формальная зарядность атома данного элемента в данном веществе. Для определения степени окисления элемента вещества необходимо знать его химическую формулу и правила определения степени окисления. Эксперты рекомендуют использовать следующие шаги для определения степени окисления элементов:
1. Определить общую зарядность ионов или групп ионов в соединении.
2. Разделить общую зарядность на количество ионов или групп ионов.
3. Полученный результат и будет степенью окисления элемента вещества.
Это позволит определить степень окисления элементов в различных химических соединениях и провести необходимые расчеты.

Правила расстановки
Прежде всего ученики должны знать, что оксиды являются сложными двухэлементными соединениями, в состав которых включен кислород.
Обязательным условием
принадлежности бинарного соединения к классу оксидов является расположение кислорода вторым в данном соединении.
Интересные факты
-
Степень окисления — это условная величина, которая характеризует степень участия атома в образовании химических связей. Она может быть положительной, отрицательной или нулевой.
-
Низшая степень окисления элемента — это минимальное значение степени окисления, которое может иметь данный элемент в своих соединениях. Она обычно соответствует степени окисления элемента в простых веществах или в соединениях с более электроотрицательными элементами.
-
Чтобы определить низшую степень окисления элемента, необходимо знать его электронную конфигурацию. Низшая степень окисления элемента равна количеству валентных электронов в атоме этого элемента.

Алгоритм для кислотных оксидов
Для начала заметим, что степени окисления это численные выражения валентности элементов. образованы неметаллами либо металлами с валентностью от четырех до семи, вторым в таких оксидах обязательно стоит кислород.
В оксидах валентность кислорода всегда соответствует двум, определить ее можно по периодической таблице элементов Д. И. Менделеева. Такой типичный неметалл как кислород, находясь в 6 группе главной подгруппы таблицы Менделеева, принимает два электрона, чтобы полностью завершить свой внешний энергетический уровень. Неметаллы в соединениях с кислородом чаще всего проявляют высшую валентность, которая соответствует номеру самой группы. Важно напомнить, что степень окисления химических элементов это показатель, предполагающий положительное (отрицательное) число.
Неметалл, стоящий в начале формулы, обладает положительной степенью окисления. Неметалл кислород же в оксидах стабилен, его показатель -2. Для того чтобы проверить достоверность расстановки значений в кислотных окислах, придется перемножить все поставленные вами цифры на индексы у конкретного элемента. Расчеты считаются достоверными, если суммарный итог всех плюсов и минусов поставленных степеней получается 0.
Опыт других людей
Степень окисления элемента вещества — это формальный заряд данного элемента в соединении. Она показывает, сколько электронов элемент отдал или принял при образовании соединения. Определить степень окисления элемента можно по правилам, учитывая его положение в периодической таблице и связанные с ним элементы. Методика подсчета степени окисления включает в себя ряд шагов, которые позволяют определить формальный заряд элемента в соединении. Это важно для понимания химических реакций и составления уравнений.

Составление двухэлементных формул
Степень окисления атомов элементов дает шанс создавать и записывать соединения из двух элементов. При создании формулы, для начала оба символа прописывают рядом, обязательно вторым ставят кислород. Сверху над каждым из записанных знаков прописывают значения степеней окисления, затем между найденными числами находится то число, что будет без какого-либо остатка делиться на обе цифры. Данный показатель необходимо поделить по отдельности на числовое значение степени окисления, получая индексы для первого и второго компонентов двухэлементного вещества. Высшая степень окисления равна численно значению высшей валентности типичного неметалла, идентична номеру группы, где стоит неметалл в ПС.
Алгоритм постановки числовых значений в основных оксидах
Подобными соединениями считаются оксиды типичных металлов. Они во всех соединениях имеют показатель степени окисления не более +1 либо +2. Для того чтобы понять, какую будет иметь степень окисления металл, можно воспользоваться периодической системой. У металлов основных подгрупп первой группы, данный параметр всегда постоянный, он аналогичен номеру группы, то есть +1.
Металлы основной подгруппы второй группы также характеризуются стабильной степенью окисления, в цифровом выражении +2. Степени окисления оксидов в сумме с учетом их индексов (числа) должны давать нуль, поскольку химическая молекула считается нейтральной, лишенной заряда, частицей.
Расстановка степеней окисления в кислородсодержащих кислотах
Кислоты представляют собой сложные вещества, состоящими из одного или нескольких атомов водорода, которые связаны с каким-то кислотным остатком. Учитывая, что степени окисления это цифровые показатели, для их вычисления потребуются некоторые математические навыки. Такой показатель для водорода (протона) в кислотах всегда стабилен, составляет +1. Далее можно указать степень окисления для отрицательного иона кислорода, она также стабильная, -2.
Лишь только после этих действий, можно вычислять степень окисления у центрального компонента формулы. В качестве конкретного образца рассмотрим определение степени окисления элементов в серной кислоте H2SO4. Учитывая, что в молекуле данного сложного вещества содержится два протона водорода, 4 атома кислорода, получаем выражение такого вида +2+X-8=0. Для того чтобы в сумме образовывался ноль, у серы будет степень окисления +6
Расстановка степеней окисления в солях
Соли представляют собой сложные соединения, состоящие из ионов металла и одного либо нескольких кислотных остатков. Методика определения степеней окисления у каждого из
составных частей
в сложной соли такая же, как и в кислородсодержащих кислотах. Учитывая, что степень окисления элементов — это цифровой показатель, важно правильно обозначить степень окисления металла.
Если металл, образующий соль, располагается в главной подгруппе, его степень окисления будет стабильной, соответствует номеру группы, является положительной величиной. Если же в соли содержится металл подобной подгруппы ПС, проявляющий разные металла можно по кислотному остатку. После того как установлена будет степень окисления металла, ставят (-2), далее вычисляют степень окисления центрального элемента, воспользовавшись химическим уравнением.
В качестве примера рассмотрим определение степеней окисления у элементов в (средней соли). NaNO3. Соль образована металлом главной подгруппы 1 группы, следовательно, степень окисления натрия будет +1. У кислорода в нитратах степень окисления составляет -2. Для определения численного значения степени окисления составляет уравнение +1+X-6=0. Решая данное уравнение, получаем, что X должен быть +5, это и есть
Основные термины в ОВР
Для окислительного, а также восстановительного процесса существуют специальные термины, которые обязаны выучить школьники.
Степень окисления атома это его непосредственная способность присоединять к себе (отдавать иным) электроны от каких-то ионов или же атомов.
Окислителем считают нейтральные атомы или заряженные ионы, в ходе
химической реакции
присоединяющие себе электроны.
Восстановителем станут незаряженные атомы или заряженные ионы, что в процессе химического взаимодействия теряют собственные электроны.
Окисление представляется как процедура отдачи электронов.
Восстановление связано с принятием дополнительных электронов незаряженным атомом или ионом.
Окислительно-восстановительны процессом характеризуется реакция, в ходе которой обязательно меняется степень окисления атома. Это определение позволяет понять, как можно определить, является ли реакция ОВР.
Правила разбора ОВР
Пользуясь данным алгоритмом, можно расставить коэффициенты в любой химической реакции.
-
Последним этапом будет расстановка стереохимических коэффициентов в рассматриваемой реакции.
Пример ОВР
Для начала нужно расставить в каждом химическом веществе степени окисления. Учтите, что в степень окисления равна нулю, так как отсутствует отдача (присоединение) отрицательных частичек. Правила расстановки степеней окисления в бинарных и трехэлементных веществ были нами рассмотрены выше.
Затем нужно определить те атомы либо ионы, у которых в ходе произошедшего превращения, изменились степени окисления.
Из левой части записанного уравнения выделяют атомы либо заряженные ионы, которые поменяли свои степени окисления. Это необходимо для составления баланса. Над элементами обязательно указывают их значения.
Далее записываются те атомы либо ионы, которые образовались в ходе реакции, указывается знаком + количество принятых атомом электронов, — число отданных отрицательных частиц. Если после процесса взаимодействия уменьшаются степени окисления. Это означает, что электроны были приняты атомом (ионом). При повышении степени окисления атом (ион) в ходе реакции отдают электроны.
Наименьшее
общее число
делят сначала на принятые, потом на отданные в процессе электроны, получают коэффициенты. Найденные цифры и будут искомыми стереохимическими коэффициентами.
Определяют окислитель, восстановитель, процессы, протекающие в ходе реакции.
Рассмотрим практическое применение данного алгоритма на конкретной химической реакции.
Fe+CuSO4=Cu+FeSO4
Рассчитываем показатели у всех простых и сложных веществ.
Так как Fe и Cu являются простыми веществами, их степень окисления равна 0. В CuSO4, то Cu+2, тогда у кислорода-2, а у серы +6. В FeSO4: Fe +2, следовательно, для О-2, по расчетам S +6.
Теперь ищем элементы, что смогли поменять показатели, в нашей ситуации ими окажутся Fe и Cu.
Так как после реакции значение у атома железа стала +2, в реакции было отдано 2 электрона. Медь поменяла свои показатели с +2 до 0, следовательно, медь приняла 2 электрона. Теперь определяем количество принятых и отданных электронов атомом железа и катионом двухвалентной меди. В ходе превращения взято два электрона катионом двухвалентной меди, столько же электронов отдано атомом железа.
В данном процессе нет смысла определять минимальное общее кратное, поскольку принято и отдано в ходе превращения равное количество электронов. Стереохимические коэффициенты будут также соответствовать единице. В реакции свойства восстановителя будет проявлять железо, при этом оно окисляется. Катион двухвалентной меди восстанавливается до чистой меди, в реакции у нее
высшая степень
окисления.
Применение процессов
Формулы степени окисления должны быть известны каждому школьнику 8-9 класса, так как данный вопрос включен в
задания ОГЭ
. Любые процессы, которые протекают с окислительными, восстановительными признаками, играют
важное значение
в нашей жизни. Без них невозможны обменные процессы в организме человека.
Часть I
1. Степень окисления (с. о.) — этоусловный заряд атомов химического элемента в сложном веществе, вычисленный на основе предположения, что оно состоит из простых ионов.
Следует знать!
1) В соединениях с. о. водорода = +1, кроме гидридов .
2) В соединениях с. о. кислорода = -2, кроме пероксидов
и фторидов
3) Степень окисления металлов всегда положительна.
Для металлов главных подгрупп первых трёх групп
с. о. постоянна:
металлы IA группы — с. о. = +1,
металлы IIA группы — с. о. = +2,
металлы IIIA группы — с. о. = +3.
4) У свободных атомов и простых веществ с. о. = 0.
5) Суммарная с. о. всех элементов в соединении = 0.
2. Способ образования названийдвухэлементных (бинарных) соединений.
4. Дополните таблицу «Названия и формулы бинарных соединений».
5. Определите степень окисления выделенного шрифтом элемента сложного соединения.
Часть II
1. Определите степени окисления химических элементов в соединениях по их формулам. Запишите названия этих веществ.
2. Разделите вещества FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3
на две группы. Запишите названия веществ, указав степени окисления.
3. Установите соответствие между названием и степенью окисления атома химического элемента и формулой соединения.
4. Составьте формулы веществ по названию.
5. Сколько молекул содержится в 48 г оксида серы (IV)?
6. С помощью Интернета и других источников информации подготовьте сообщение о применении какого-либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
H2O вода, оксид водорода.
Вода при
обычных условиях
жидкость, без цвета, запаха, в толстом слое – голубая. Температура кипения около 100⁰С. Является хорошим растворителем. Состоит молекула воды из двух атомов водорода и одного атома кислорода, это его качественный и количественный состав. Это сложное вещество, для него характерны следующие
химические свойства
: взаимодействие со щелочными металлами, щелочноземельными металлами. Реакции обмена с водой называются гидролизом. Эти реакции имеют
большое значение
в химии.
7. Степень окисления марганца в соединении К2МnO4 равна:
3) +6
8. Наименьшую степень окисления хром имеет в соединении, формула которого:
1) Сг2O3
9. Максимальную степень окисления хлор проявляет в соединении, формула которого:
3) Сl2O7
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять
разные значения
. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Степень окисления. Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. Степень окисления может быть положительным, отрицательным или равным нулю. Он обозначается
арабской цифрой
со знаком «плюс» или «минус» над символом элемента.
2. При определении степеней окисления исходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
3. Если соединение образована атомами одного элемента (в простой веществе), то степень окисления этих атомов равен нулю.
4. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
5. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 (KH, BaH 2).
6. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 (H 2 O 2 , Na 2 O 2 или +2 (OF 2).
7. Атомы многих химических элементов оказывают переменные степени окисления.
8. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
9. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
10. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже отрицательный степень окисления равна разнице между номером группы и цифрой восемь.
11. Степень окисления атома образует простой ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенным правилам, определим степени окисления химических элементов в составе H 2 SO 4 . Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О:.
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равно х:.
Составим уравнения, умножив для каждого элемента его индекс в степень окисления и добытую сумму приравняем к нулю: 2 · (+1) + x + 4 · (-2) = 0
Следовательно, степень окисления серы равна плюс шесть:.
В следующем примере выясним, как можно составить формулу соединения с
известными степенями
окисления атомов элементов. Составим формулу феррум (III) оксида. Слово «оксид» означает, что справа от символа железа надо записать символ кислорода: FeO.
Отметим степени окисления химических элементов над их символами. Степень окисления железа указана в названии в скобках (III), следовательно, равна +3, степень окисления кислорода в оксидах -2:.
Найдем наименьшее общее кратное для чисел 3 и 2, это 6. Разделим число 6 на 3, получим число 2 — это индекс для железа. Разделим число 6 на 2, получим число 3 — это индекс для кислорода:.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов и зарядами ионов. Составим формулу кальций ортофосфата. Слово «ортофосфат» означает, что справа от символа Кальция надо записать кислотный остаток ортофосфатнои кислоты: CaPO 4 .
Отметим степень окисления кальция (правило номер четыре) и заряд кислотного остатка (по таблице растворимости):.
Найдем наименьшее общее кратное для чисел 2 и 3, это 6. Разделим число 6 на 2, получим число 3 — это индекс для кальция. Разделим число 6 на 3, получим число 2 — это индекс для кислотного остатка:.
Кристаллические решетки
Кристаллические решетки. Атомные, молекулярные и ионные кристаллы. Зависимость физических свойств веществ от типов кристаллических решеток
В кристаллических веществах атомы, молекулы и ионы расположены упорядоченно, на определенных расстояниях. Такое закономерное расположение частиц в кристаллах называют кристаллической решеткой. Зависимости от того, какие частицы находятся в узлах этой решетки, различают ионные, атомные и молекулярные кристаллические решетки. Известны также и металлические кристаллические решетки.
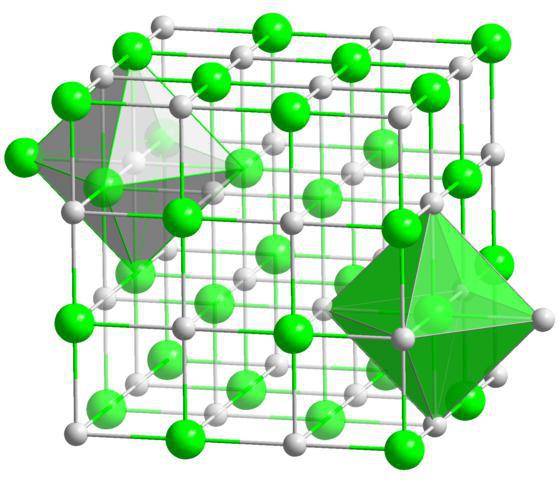
Ионные кристаллические решетки характерны для соединений с ионным типом химической связи. В узлах таких решеток находятся противоположно заряженные ионы. Силы мижионнои взаимодействия являются весьма значительными, поэтому вещества с таким типом кристаллической решетки является нелетучими, твердыми, тугоплавкими, их растворы и расплавы проводят электрический ток.
Типичными представителями
таких соединений являются соли, например, натрия хлорид, калия нитрат и другие.
Атомные кристаллические решетки характерны для соединений с ковалентной типом химической связи. В узлах таких решеток находятся отдельные атомы, связанные ковалентными связями. Все связи равноценны и крепкими, поэтому вещества с таким типом кристаллической решетки характеризуются большой твердостью,
высокими температурами
плавления, химической инертностью. Такой тип кристаллической решетки характерно для алмаза, кремний (IV) оксида, бора.
Молекулярные кристаллические решетки характерны для соединений с ковалентной типом химической связи. В узлах таких решеток находятся неполярные или полярные молекулы. Вследствие слабых сил взаимодействия вещества с таким типом кристаллической решетки имеют незначительную твердость, низкие температуры плавления и кипения, характеризуются летучестью. Такой тип кристаллической решетки характерно для кислорода, йода, воды, глюкозы, спиртов, нафталина.
Таким образом, существует определенная связь между типом кристаллической решетки и
физическими свойствами
вещества. Поэтому, если известна строение вещества, то можно прогнозировать ее свойства и, наоборот, если известны свойства вещества, то можно определить ее строение.
Ковалентная связь, его виды — полярная и неполярная
Ковалентная связь, его виды — полярная и неполярная. Образование ковалентной неполярного связи. Образование ковалентной полярной связи. Электронные формулы молекул веществ
Ковалентная связь— это химическая связь, образующаяся за счет общих электронных пар.
Рассмотрим механизм образования ковалентной связи на примере молекулы водорода H 2 . Атомы водорода имеют электронную формулу: 1 H 1s 1 .
При сближении двух атомов водорода происходит взаимодействие двух электронов с антипараллельными спинами (обозначаются электроны стрелками с разным направлениям) с формированием общей (поделенной) электронной пары.
Схему образования ковалентной связи можно представить, обозначая неспаренный электрон внешнего уровня одной точкой, а общую электронную пару — двумя точками. Общую электронную пару, т.е. ковалентная связь, часто обозначают чертой. Общая электронная пара образуется в результате перекрывания s-орбиталей атомов водорода, при этом в области перекрывания орбиталей создается повышенная электронная плотность.
Рассмотрим образование ковалентной связи в молекуле хлора Cl2. Атомы хлора имеют электронную формулу: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5 .
Атом хлора имеет семь электронов на внешнем энергетическом уровне, причем на 3p — подуровни находится один неспаренный электрон. При сближенном двух атомов хлора происходит перекрытие 3p — орбиталей с неспаренными электронами и образование общей электронной пары. У каждого атома хлора в молекуле Cl 2 хранятся три неразделенные электронные пары (которые принадлежат одному атому).
В молекуле водорода H2, как и в молекуле хлора Cl 2 , образуется простой (одинарный) связь. Существуют молекулы, в которых между двумя атомами возникают две или три электронные пары. Такие ковалентные связи называют, соответственно, двойными или тройными. Общее название двойных и тройных связей — кратные связи.
Например, рассмотрим образования ковалентной связи в молекуле кислорода O 2 . Атомы кислорода имеют электронную формулу: 8 O 1s 2 2s 2 2p 4 .
Атом кислорода имеет шесть электронов на внешнем энергетическом уровне, причем на 2p — подуровни находится два неспаренных электрона. В образовании химической связи в молекуле O 2 участвуют по два электрона каждого атома кислорода. В
данном случае
образуются две общие электронные пары (двойная связь). У каждого атома кислорода в молекуле O 2 хранятся две неразделенные электронные пары.
При образовании ковалентной связи в молекуле водорода каждый из атомов водорода является устойчивой двохелектроннои конфигурации за счет образования общей электронной пары. В других случаях при образовании ковалентной связи, например, в молекулах хлора и кислорода каждый из атомов является устойчивой конфигурации, состоящей из восьми электронов.
В случае всех трех рассмотренных молекул (водорода, хлора и кислорода) ковалентная связь образовался между атомами с одинаковой электроотрицательностью. Такое взаимодействие наблюдается при образовании простых веществ-неметаллов, молекулы которых состоят из двух одинаковых атомов. В этом случае общие электронные пары располагаются симметрично между ядрами атомов, соединяются. Вследствие этого образуются молекулы, в которых центры положительных и отрицательных зарядов совпадают.
Итак, ковалентная связь, которая образуется между атомами с одинаковой электроотрицательностью за счет общих электронных пар, называют ковалентной неполярной связью. Надо запомнить, что такой тип химической связи образуется в простых веществах-неметаллов. Как примеры веществ с ковалентной неполярной типом связи можно назвать фтор F 2 , бром Br 2 , йод I 2 , азот N 2 .
Если атомы, которые взаимодействуют, имеют различную электроотрицательность (атомы различных химических элементов), то общая электронная пара будет смещаться к атому с большей электроотрицательностью. При этом на атоме с большей электроотрицательностью формируется частичный отрицательный заряд, а на атоме с меньшей электроотрицательностью — частичный положительный заряд. Эти частичные заряды по абсолютному значению меньше единицы.
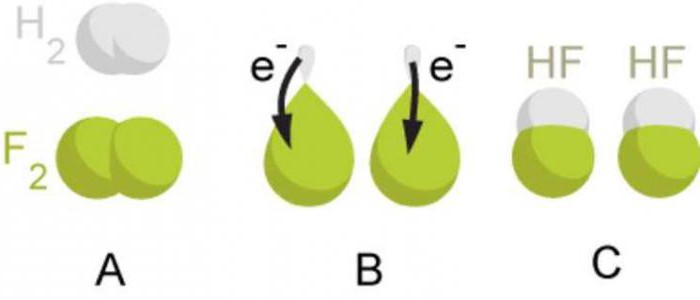
Например, при образовании молекулы водород хлорида HCl происходит перекрывание s-орбитали атома водорода и p-орбитали атома хлора. Общая электронная пара расположена несимметрично относительно центров атомов, которые взаимодействуют. Она смещается в более электроотрицательного хлора. На атоме хлора формируется частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд. В этом случае в молекуле центры положительных и отрицательных зарядов не совпадают. Такие молекулы называют полярными, или диполями. Диполь — это система из двух зарядов, которые являются одинаковыми по величине, но противоположными по знаку.
Итак, ковалентная связь, которая образуется между атомами, электроотрицательности которых отличаются, но незначительно, называют ковалентной полярной связью. Надо запомнить, что такой тип химической связи образуется в сложных веществах, образованных атомами неметаллов. Как примеры веществ с ковалентной полярным типом связи можно назвать водород фторид HF, вода H 2 O, аммиак NH 3 , метан CH 4 , карбон (IV) оксид CO 2 .
Ионная связь образуется в результате полного переноса одного или нескольких электронов от одного атома к другому. Такой тип связи возможен только между атомами элементов, электроотрицательности которых значительно отличаются. При этом происходит переход электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Надо запомнить, что такой тип химической связи образуется между атомами металлов и неметаллов. Например, элементы первой и второй группы главных подгрупп
периодической системы
(типичные металлы) непосредственно соединяются с элементами шестой и седьмой группы главных подгрупп периодической системы (типичные неметаллы).
Рассмотрим механизм образования ионного связи в составе калий хлорид. Атом калия содержит один валентный электрон (определяем по номеру группы, в которой находится Калий). Атом хлора содержит семь валентных электронов (определяем по номеру группы, в которой находится Хлор). При взаимодействии атомов калия с атомами хлора валентный электрон атома калия полностью переходит на внешний уровень атома хлора, достраивая его в восьмиелектроннои структуры. При этом атом калия, теряя электрон, приобретает положительный заряд +1 и превращается в катион K + , а атом хлора, присоединяя электрон, приобретает отрицательный заряд -1 и превращается в анион Cl — . Разноименно заряженные ионы притягиваются благодаря электростатическим силам и образуется соединение калий хлорид. Этот процесс можно изобразить схемой:
Лишь некоторые химические элементы (благородные газы) при обычных условиях находятся в состоянии одноатомного газа. Атомы других элементов, наоборот, в индивидуальном виде не существуют, а входят в состав молекул или кристаллических решеток, образованных совокупностью атомов. Итак, существует причина, по которой атомы связываются друг с другом. Этой причиной является химическая связь, обусловленный тем, что между атомами действуют определенные электростатические силы, способные удерживать атомы друг к другу. Доказано, что в образовании химической связи между атомами
главная роль
принадлежит валентным электронам (электронам внешнего уровня, слабое связанные с ядром).
Согласно теории химической связи наибольшую прочность имеют внешние оболочки, состоящие из двух или восьми электронов. Благородные газы имеют такие электронные оболочки. Это и является причиной того, что благородные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы, имеющие на внешнем уровне менее восьми (или двух) электронов, пытаются приобрести структуры благородных газов. Поэтому при образовании молекулы в ходе химической реакции атомы стараются приобрести устойчивую восьмиелектронну или двохелектронну оболочку.
Образование устойчивой электронной конфигурации может происходить некоторыми способами и приводить к образованию молекул или немолекулярного соединений различного строения. Вследствие этого различают ковалентные и ионный типы химической связи. Кроме этих видов, существуют другие типы химической связи: металлический и водородный (межмолекулярных).
Формальный заряд атома в соединениях — вспомогательная величина, обычно ее используют в описаниях свойств элементов в химии. Этот условный электрический заряд и есть степень окисления. Его значение изменяется в результате многих химических процессов. Хотя заряд является формальным, он ярко характеризует свойства и поведение атомов в окислительно-восстановительных реакциях (ОВР).
Окисление и восстановление
В прошлом химики использовали термин «окисление», чтобы описать взаимодействие кислорода с другими элементами. Название реакций произошло от латинского наименования кислорода — Oxygenium. Позже выяснилось, что другие элементы тоже окисляют. В этом случае они восстанавливаются — присоединяют электроны. Каждый атом при образовании молекулы изменяет строение своей валентной электронной оболочки. В этом случае появляется формальный заряд, величина которого зависит от количества условно отданных или принятых электронов. Для характеристики этой величины ранее применяли английский химический термин «oxidation number», который в переводе означает «окислительное число». При его использовании исходят из допущения, что связывающие электроны в молекулах или ионах принадлежат атому, обладающему более
высоким значением
электроотрицательности (ЭО). Способность удерживать свои электроны и притягивать их от других атомов хорошо выражена у сильных неметаллов (галогенов, кислорода). Противоположными свойствами обладают сильные металлы (натрий, калий, литий, кальций, другие щелочные и щелочноземельные элементы).
Определение степени окисления
Степенью окисления называют заряд, который атом приобрел бы в том случае, если бы принимающие участие в образовании связи электроны полностью сместились к более электроотрицательному элементу. Есть вещества, не имеющие молекулярного строения (галогениды щелочных металлов и другие соединения). В этих случаях степень окисления совпадает с зарядом иона. Условный или реальный заряд показывает, какой процесс произошел до того, как атомы приобрели свое нынешнее состояние. Положительное значение степени окисления — это общее количество электронов, которые были удалены из атомов.
Отрицательное значение
степени окисления равно числу приобретенных электронов. По изменению состояния окисления химического элемента судят о том, что происходит с его атомами в ходе реакции (и наоборот). По цвету вещества определяют, какие произошли перемены в состоянии окисления. Соединения хрома, железа и ряда других элементов, в которых они проявляют разную валентность, окрашены неодинаково.
Отрицательное, нулевое и положительное значения степени окисления
Простые вещества образованы
химическими элементами
с
одинаковым значением
ЭО. В этом случае связывающие электроны принадлежат всем структурным частицам в равной степени. Следовательно, в простых веществах элементам несвойственно состояние окисления (Н 0 2 , О 0 2 , С 0). Когда атомы принимают электроны или общее облако смещается в их сторону, заряды принято писать со знаком «минус». Например, F -1 ,О -2 , С -4 . Отдавая электроны, атомы приобретают реальный или формальный положительный заряд. В оксиде OF 2 атом кислорода отдает по одному электрону двум атомам фтора и находится в состоянии окисления О +2 . Считают, что в молекуле или многоатомном ионе более электроотрицательные атомы получают все связывающие электроны.
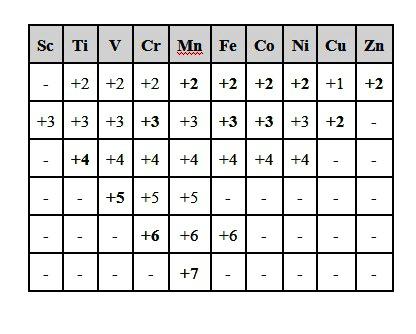
Сера — элемент, проявляющий разные валентность и степени окисления
Химические элементы главных подгрупп зачастую проявляют низшую валентность равную VIII. Например, валентность серы в сероводороде и сульфидах металлов — II. Для элемента характерны промежуточные и высшая валентность в возбужденном состоянии, когда атом отдает один, два, четыре или все шесть электронов и проявляет соответственно валентности I, II, IV, VI. Такие же значения, только со знаком «минус» или «плюс», имеют степени окисления серы:
- в сульфиде фтора отдает один электрон: -1;
- в сероводороде низшее значение: -2;
- в диоксиде промежуточное состояние: +4;
- в триоксиде, серной кислоте и сульфатах: +6.
В своем высшем состоянии окисления сера только принимает электроны, в низшей степени — проявляет сильные восстановительные свойства. Атомы S +4 могут проявлять в соединениях функции восстановителей или окислителей в зависимости от условий.
Переход электронов в химических реакциях
При образовании кристалла поваренной соли натрий отдает электроны более электроотрицательному хлору. Степени окисления элементов совпадают с зарядами ионов: Na +1 Cl -1 . Для молекул, созданных путем обобществления и смещения электронных пар к более электроотрицательному атому, применимы только представления о формальном заряде. Но можно предположить, что все соединения состоят из ионов. Тогда атомы, притягивая электроны, приобретают условный отрицательный заряд, а отдавая, — положительный. В реакциях указывают, какое число электронов смещается. Например, в молекуле диоксида углерода С +4 О — 2 2 указанный в верхнем правом углу индекс при химическом символе углерода отображает количество электронов, удаленных из атома. Для кислорода в этом веществе характерно состояние окисления -2. Соответствующий индекс при химическом знаке О — количество добавленных электронов в атоме.
Как подсчитать степени окисления
Подсчет количества отданных и присоединенных атомами электронов может отнять много времени. Облегчают эту задачу следующие правила:
- В простых веществах степени окисления равны нулю.
- Сумма окисления всех атомов или ионов в нейтральном веществе равна нулю.
- В сложном ионе сумма степеней окисления всех элементов должна соответствовать заряду всей частицы.
- Более электроотрицательный атом приобретает отрицательное состояние окисления, которое записывают со знаком «минус».
- Менее электроотрицательные элементы получают положительные степени окисления, их записывают со знаком «плюс».
- Кислород в основном проявляет степень окисления, равную -2.
- Для водорода
характерное значение
: +1, в гидридах металлов встречается: Н-1. - Фтор — наиболее электроотрицательный из всех элементов, его состояние окисления всегда равно -4.
- Для большинства металлов окислительные числа и валентности совпадают.
Степень окисления и валентность
Большинство соединений образуются в результате окислительно-восстановительных процессов. Переход или смещение электронов от одних элементов к другим приводит к изменению их состояния окисления и валентности. Зачастую эти величины совпадают. В качестве синонима к термину «степень окисления» можно использовать словосочетание «электрохимическая валентность». Но есть исключения, например, в ионе аммония азот четырехвалентен. Одновременно атом этого элемента находится в состоянии окисления -3. В органических веществах углерод всегда четырехвалентен, но состояния окисления атома С в метане СН 4 , муравьином спирте СН 3 ОН и кислоте НСООН имеют другие значения: -4, -2 и +2.
Окислительно-восстановительные реакции
К окислительно-восстановительным относятся многие
важнейшие процессы
в промышленности, технике, живой и
неживой природе
: горение, коррозия, брожение, внутриклеточное дыхание, фотосинтез и другие явления.
При составлении уравнений ОВР подбирают коэффициенты, используя метод электронного баланса, в котором оперируют следующими категориями:
- степени окисления;
- восстановитель отдает электроны и окисляется;
- окислитель принимает электроны и восстанавливается;
- число отданных электронов должно быть равно числу присоединенных.
Приобретение электронов атомом приводит к понижению его степени окисления (восстановлению). Утрата атомом одного или нескольких электронов сопровождается повышением окислительного числа элемента в результате реакций. Для ОВР, протекающих между ионами сильных электролитов в водных растворах, чаще используют не электронный баланс, а метод полуреакций.
Возможно, будет полезно почитать:
- Магниты и магнитное поле проводника с током
; - Кого называют солнечным человеком
; - Однозначные и многозначные слова (примеры)
; - Вера божья и вера человеческая
; - Притчи о жизни с моралью – короткие Добрые притчи о добре
; - Рак предсказания на любовный гороскоп
; - Дельвиг, Антон Антонович – краткая биография
; - Афанасий никитин, русский путешественник
;
Частые вопросы
Как определить низшую степень окисления?
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8. Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Как определить степень окисления элемента?
Степень окисления равна числу электронов, смещённых от атома или к атому. Если электроны смещаются от атома, то его степень окисления положительная. Положительная степень окисления у атома с меньшей электроотрицательностью. Если смещение электронов происходит к атому, то его степень окисления отрицательная.
Как определить низшую степень окисления по таблице Менделеева?
Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов равна: – (8 – номер группы, в которой находится элемент).
Чему равна низшая степень окисления?
Высшая степень окисления определяется, как правило, по номеру группы. Минимальная степень окисления металлов равна нулю, а неметаллов № группы -8. Степень окисления простых веществ равна нулю.
Полезные советы
СОВЕТ №1
Изучите таблицу степеней окисления элементов, чтобы понимать, какие значения могут принимать степени окисления различных элементов.
СОВЕТ №2
При определении степени окисления элемента в соединении, учитывайте общий заряд соединения и известные степени окисления других элементов.
СОВЕТ №3
Помните, что степень окисления элемента в простом веществе (например, Fe в металлическом железе) равна нулю.