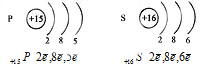Фосфор (Р) — типичный неметалл с относительной атомной массой 31. Строение атома фосфора определяет его активность. Фосфор легко вступает в реакции с другими веществами и элементами.
Строение
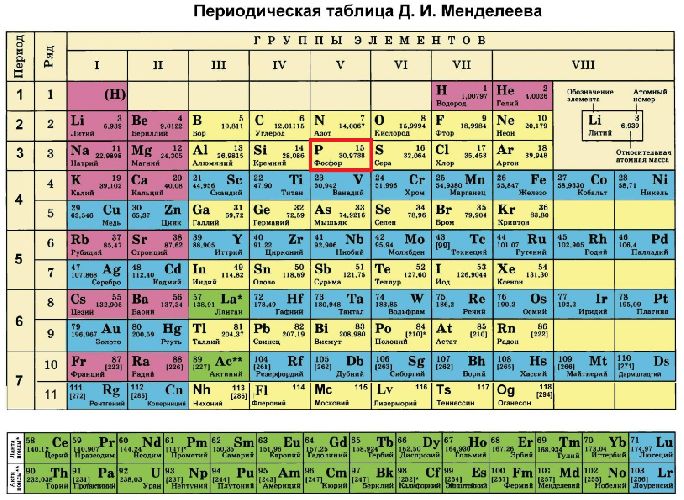
Строение атома элемента фосфора отражено в периодической таблице Менделеева. Фосфор расположен под 15 номером в пятой группе, третьем периоде. Следовательно, атом фосфора состоит из положительно заряженного ядра (+15) и трёх электронных оболочек, на которых находится 15 электронов.
Рис. 1. Положение в таблице Менделеева.
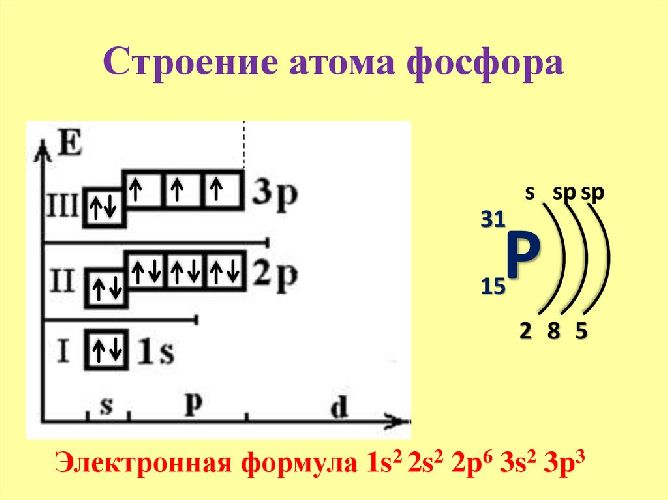
Графически расположение строение атома выглядит следующим образом:
- +15 P) 2) 8) 5 ;
- 1s 2 2s 2 2p 6 3s 2 3p 3 .
Фосфор относится к р-элементам. На внешнем энергетическом уровне в возбуждённом состоянии располагается пять электронов, которые определяют валентность элемента. В обычном состоянии внешний уровень остаётся незавершённым. Три неспаренных электрона указывают на степень окисления (+3) и третью валентность. Фосфор легко переходит из обычного в возбуждённое состояние.
Рис. 2. Строение фосфора.
Ядро состоит из 15 протонов и 16 нейронов. Чтобы посчитать количество нейронов, необходимо вычесть из относительной атомной массы порядковый номер элемента — 31-15=16.
Мнение эксперта:
Эксперты отмечают, что презентация на тему «Фосфор: строение и свойства» является важным и актуальным источником информации о данном химическом элементе. Представление основных характеристик фосфора, его структуры и свойств позволяет более глубоко понять его роль в различных процессах, в том числе в биологических системах. Эксперты отмечают, что такая презентация может быть полезной для студентов, научных работников и специалистов в области химии и биологии, помогая им расширить свои знания и углубить понимание данной темы.

Аллотропия
Фосфор имеет несколько аллотропических модификаций, отличающихся строением кристаллической решётки:
- белый— ядовитое вещество, напоминающее воск, светится в темноте, т.к. окисляется при низких температурах;
- жёлтый— неочищенный белый фосфор (имеет примеси);
- красный— менее ядовитое вещество, чем белый или жёлтый фосфор, не воспламеняется и не светится;
- чёрный— похожее на графит вещество с металлическим блеском, проводит электрический ток, может переходить в металлический фосфор.
Рис. 3. Виды фосфора.
Белый фосфор — наиболее активная модификация элемента, которая быстро окисляется на воздухе, поэтому белый фосфор хранят под водой.
Интересные факты
-
Фосфор — один из самых распространенных элементов на Земле, занимающий 11-е место по распространенности. Он составляет около 0,1% от массы земной коры и содержится во многих минералах, таких как апатит, фосфорит и фосфаты.
-
Фосфор является важным элементом для жизни, так как он входит в состав нуклеиновых кислот (ДНК и РНК), которые отвечают за хранение и передачу генетической информации. Кроме того, фосфор участвует в энергетическом обмене, входит в состав костей и зубов, а также участвует в работе нервной системы.
-
Фосфор имеет несколько аллотропных модификаций, наиболее распространенными из которых являются белый фосфор, красный фосфор и черный фосфор. Белый фосфор — это высокореактивное вещество, которое легко воспламеняется и может вызвать серьезные ожоги. Красный фосфор — это менее реактивное вещество, которое не воспламеняется так легко, как белый фосфор. Черный фосфор — это самая стабильная форма фосфора, которая имеет низкую реактивность и не воспламеняется.

Свойства
Фосфор образует:
- фосфорную кислоту (H 3 PO 4);
- оксиды P 2 O 5 и P 2 O 3 ;
- фосфин — летучее ядовитое соединение с водородом (PH 3).
Фосфор реагирует c простыми веществами — металлами и неметаллами, проявляя окислительно-восстановительные свойства. Основные реакции с фосфором описаны в таблице.
Фосфор образует около 200 минералов, один из которых — апатит. Фосфор входит в состав жизненно важных соединений — фосфолипидов, которые составляют все клеточные мембраны.
Опыт других людей
Презентация на тему «Фосфор: строение и свойства» вызвала яркие эмоции у слушателей. Один из участников отметил, что презентация была информативной и понятной даже для непрофессионалов. Другой выразил восхищение тем, как автор смог простыми словами объяснить сложные химические процессы. Еще один слушатель подчеркнул, что презентация пробудила его интерес к изучению фосфора и его свойств. Общее мнение участников было положительным, и многие выразили желание узнать больше на эту тему.

Что мы узнали?
Рассмотрели схему строения атома фосфора. Формула атома — 1s 2 2s 2 2p 6 3s 2 3p 3 . Элемент может переходить в возбуждённое состояние с валентностью V. Известно несколько модификаций фосфора — белый, жёлтый, красный, чёрный. Самый активный — белый фосфор — способен самовоспламеняться в присутствии кислорода. Элемент реагирует со многими металлами и неметаллами, а также с кислотами, основаниями и водой.
Тест по теме
Оценка доклада
Средняя оценка:
3.9
. Всего получено оценок: 104.
«Химия. 8 класс». О.С. Габриелян
Вопрос 1 (1).
а) — схема строения атома алюминия; б) — схема строения атома фосфора; в) — схема строения атома кислорода.
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
Строение электронной оболочкиэтих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора — 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Одним из используемых легирующих материалов является фосфор. Фосфор имеет пять электронов в своей внешней оболочке. То, что происходит, когда атом фосфора соединяется с кристаллической структурой с кремнием, заключается в том, что один электрон в своей внешней оболочке не может соединяться с атомом кремния и поэтому свободен.
Этот элемент имеет только три электрона в своей внешней оболочке. Когда эта добавка добавляется во время производства, появляется свободное пространство или отверстие, где «электрон» может входить в кристаллическую решетку кремния. Отверстия считаются положительными носителями заряда, хотя они не содержат физического заряда. Способность атома кремния принять другой электрон в его внешней оболочке делает отверстие, по-видимому, положительным зарядом. Отверстия делают проводящий кристалл кремния.
Вопрос 3 (3).
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n 2 , где n — номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 1 2 = 2), а во втором периоде 8 элементов (2 . 2 2 = 8).
К одному, смотрящему на прыжки электронов, кажется, что дырки в кремнии движутся в противоположном направлении к потоку электронов. Выделено происхождение сегнетоэлектричества. Увеличение и перегруппировка ковалентности химических связей связаны с изменением валентной зоны при переходе от параэлектрической фазы к сегнетоэлектрической. Ключевые слова: сегнетоэлектричество, фазовый переход, химическое связывание.
Строение атомов. Строение электронной оболочки атома
Если понижение энергии, связанное с гибридизационным взаимодействием, больше, чем интерсиональное отталкивание, противоположное ионному сдвигу, то возникает сегнетоэлектрическое искажение. Эта «стереохимическая активность одиночной пары» является движущей силой нецентрального искажения в сегнетоэлектриках. Этот эффект определяется балансом положительного и отрицательного вклада в общую энергию. Первый описывает короткодействующие силы отталкивания и связан с жесткими сдвигами ионов от исходных положений с высокой симметрией.
Вопрос 5 (5).
В астрономии — Период вращения Земли вокруг своей оси 24 часа.
В географии — Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике — Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии — Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Второй отрицательный вклад описывает релаксацию электронной конфигурации в ответ на смещения ионов за счет образования ковалентных связей . Этот термин благоприятствует сегнетоэлектрическому искажению. Здесь появляется противоположная картина по сравнению с перовскитами, где единственная решетчатая мода может определять динамическую неустойчивость, связанную с сегнетоэлектрическим фазовым переходом. Рентгеновская фотоэлектронная спектроскопия подтверждает рост ковалентности химических связей в сегнетоэлектрической фазе.
На их сегнетоэлектрические свойства эффективно влияет состояние электронной подсистемы. Сравнение экспериментальных и расчетных релаксированных значений констант решетки демонстрирует разницу порядка 3% по порядку величины. Видно, что для кластеров уровень энергии около -15 эВ в основном определяется гибридизацией орбиталей фосфора.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
Конспект урока химии в 9 классе по теме:
«Фосфор. Строение атома, аллотропия, свойства и применение фосфора» с презентацией
Тема урока:
«Фосфор. Строение атома, аллотропия, свойства и применение фосфора».
Цель урока:
Определить положение фосфора в периодической системе химических элементов Д.И. Менделеева, рассмотреть строение атома фосфора, физические и химические свойства, области применения фосфора.
Задачи урока:
Образовательные:
- Рассмотреть строение атома фосфора согласно его положение в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации фосфора.
- Изучить физические и химические свойства фосфора, нахождение в природе, его области применения.
- Продолжить формирование умения учащихся работать с периодической системой химических элементов Д. И. Менделеева.
- Совершенствовать умения составлять уравнения химических реакций.
Развивающие:
- Развивать память и внимание учащихся.
- Формировать положительную мотивацию на изучение предмета химии.
- Учить применять имеющиеся знания в новой ситуации.
Воспитательные:
- Показать значимость химических знаний для современного человека.
Оборудование:
ПСХЭ, компьютер, мультимедийный проектор, электронное пособие «Видеодемонстрации».
Тип урока:
Комбинированный. Урок изучения нового материала.
Формы организации учебной деятельности:
- самостоятельная работа с текстом учебника;
- фронтальная;
- сообщения учащихся (индивидуальная);
- работа в группах.
Методы обучения. Методы организации учебной деятельности:
- словесные (эвристическая беседа),
- наглядные (коллекция, видеофрагмент) на основе познавательной деятельности
- частично-поисковый;
Педагогические приемы:
- учебно-организационные (определение цели и задачи урока, создание благоприятных условий деятельности);
- учебно — информационные (беседа, постановка проблемы, ее обсуждение, работа с учебником, наблюдение);
- учебно — интеллектуальные (восприятие, осмысление, запоминание информации, решение проблемных задач, мотивация деятельности).
Ход урока.
I.Организационный момент.
Психологический настрой учащихся, проверка готовности к уроку.
Учитель приветствует учащихся.
II.Актуализация знаний (слайд 2.)
Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами.
Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, — сказал я».
Артур Конан-Дойл. «Собака Баскервилей»
Вот в какой скверной истории оказался замешан элемент N 15
Итак, тема урока — «Фосфор. Строение атома, аллотропия, свойства и применение фосфора» цель и задачи урока (слайды 3, 4)
III. Изучение нового материала.
1. Положение фосфора в периодической системе химических элементов (слайд 5, 6)
Задание: Используя периодическую систему химических элементов, дайте характеристику химическим элементам фосфора и азота, заполните таблицу.
Вариант 1 — положение в ПСХЭ и строение атома азота.
Вариант 2 — положение в ПСХЭ и строение атома фосфора.
Найдите черты сходства, различия между строением атома азота и фосфора.
Вывод: Оба элемента находятся в главной подгруппе V группы ПСХЭ, на последнем энергетическом уровне по 5 электронов, имеют одинаковые значения низших степеней окисления -3 (если проявляют окислительные свойства, например, с металлами, водородом) и +5 в кислородсодержащих соединениях.
2. Валентное состояние атома фосфора (слайд 7) — объяснение учителя.
3. Нахождение в природе (слайд 8) -работа с учебником.
Задание классу:
В каком виде фосфор встречается в природе?
Лабораторный опыт № 1.
- Рассмотрите образцы минералов, содержащих фосфор.
- Запишите названия и формулы предложенных минералов в тетрадь.
4. Физические свойства
Аллотропные модификации фосфора (слайд 9,10)-объяснения учителя
А) белый фосфор (слайд 11,12);
Б) красный фосфор (слайд 13,14);
В) черный фосфор (слайд 15,16);
Вывод: Три аллотропные модификации — белый, красный, черный.
5. Химические свойства фосфора (слад 17)
1) Взаимодействие фосфора с простыми веществами:
А) с металлами, образуя фосфиды.
Например, взаимодействие белого фосфора с кальцием.
Задание: Запишите уравнение реакции, составьте уравнение электронного баланса.
Б) Взаимодействие фосфора с неметаллами.
Например: Взаимодействие фосфора и кислорода (видеофрагмент).
Задание:
- Запишите уравнения реакции, составьте уравнение электронного баланса.
- Как горит фосфор на воздухе и в кислороде?
В) Взаимодействие фосфора со сложными веществами (хлоратом калия) (слайд 18)
6P + 5KClO3 → 5KCl + 3P2O5
6. Применение фосфора (слайд 19) — выступление учащегося.
III.Закрепление изученного материала (фронтальный опрос):
1.Охарактеризуйте положение фосфора в периодической системе химических элементов Д.И. Менделеева.
2.В каком соединении фосфор проявляет степень окисления -3? (слайд 20)
А) Н3РО4
Б) РН3
В) HРO3
3. В каком виде фосфор находится в природе? Охарактеризуйте физические свойства фосфора (красного, белого, черного).
4.С каким веществом реагирует фосфор образуя фосфид:
А) водой
Б) водородом
В) магнием
IV.Домашнее задание (слайд 23): § 22, упр. 3
V.Рефлексия
- Что нового вы узнали на уроке?
- Какой момент урока вам понравился?
- Какое впечатление у вас осталось от урока?
VI. Подведение итогов и выводы урока.
ОПРЕДЕЛЕНИЕ
Фосфоррасположен в третьем периоде V группы главной (А) подгруппы Периодической таблицы.
Относится к элементам
p-семейства. Неметалл. Обозначение — P. Порядковый номер — 15. Относительная атомная масса — 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
15 P) 2) 8) 5 ;
1
s2 2
s2 2
p6 3
s2 3
p3 .
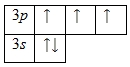
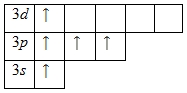
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел:
n(главное квантовое),
l(орбитальное),
m l(магнитное) и
s(спиновое):
|
Подуровень |
||||
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3
d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Элемент состоит из двух изотопов в соотношении 2:3. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. Определите атомную массу второго изотопа, если средняя относительная масса элемента равна 21,2. В ответе укажите на сколько нейтронов больше в ядре атома второго изотопа. |
| Решение | Относительная атомная масса первого изотопа равна:
A 1 = Z +n = 10 + 10 = 20 а.е.м. Относительную атомную массу второго изотопа обозначим через A 2 . Средняя относительная атомная масса элемента определяется суммой масс его изотопов с учетом их количества. Составим уравнение: A ср ×5 = A 1 ×2 + A 2 ×3; 21,5 ×5 = 20 ×2 + A 2 ×3; A 2 = 22 а.е.м. В ядре атома второго изотопа 10 протонов, следовательно, число, нейтронов будет равно n= A- Z =.22 — 10= 12. По условию задачи в ядре атома первого изотопа было 10 нейтронов. Значит, ядро атома второго изотопа содержит на два нейтрона больше, чем ядро первого изотопа. |
| Ответ | Относительная атомная масса второго изотопа равна 22 а.е.м. |
В Парижской библиотеке хранится манускрипт по алхимии, в котором описано
открытие фосфора. Если верить документу, выделить элемент в чистом виде впервые удалось Алхид Бахилу.
Он жил в 12-ом веке.
Фосформужчина получил, перегоняя мочу с известью и . Алхимик назвал светящееся вещество эскарбуклем. Современное имя элементу дал Хеннинг Бранд.
Он соединил греческие слова «свет» и «несу». Немец выделил
белый фосфорв 1669-ом году, задокументировав свою заслугу, выступив перед ученым сообществом.
Хеннинг Бранд, как и Алхид Бахил, воспользовался выпаренной мочой, но нагревал ее с белым песком. В 17-ом веке, да и в 12-ом, свечение полученного вещества казалось чудом. У современников на физические
свойства фосфораиной взгляд.
Физические и химические свойства фосфора
Элемент фосфорсветится из-за процессов окисления. Взаимодействие с кислородом проходит быстро, возможно самовоспламенение.
Скорое и обильное высвобождение химической энергии приводит к ее переходу в энергию света. Процесс проходит даже при комнатной температуре.
Вот и секрет сияния
фосфора. Кислородпроще всего реагирует с белой модификацией элемента. Ее можно перепутать с воском, свечным парафином. Плавится вещество уже при 44-х градусах Цельсия.
Свойства фосфорабелого цвета отличаются от свойств других модификаций элемента. Они, к примеру, не токсичны.
Бесцветный же фосфор ядовит, нерастворим в воде. Ей, как правило, и блокируют окисление порошка. Не вступая в реакцию с водой,
белый фосфорлегко растворяется органике, к примеру, сероуглероде.
В первой модификации
вещество фосфорнаименее плотное. На кубический метр приходится лишь 1 800 граммов. При этом, смертельной дозой для человека является всего 0,1 грамм.
Еще ядовитее
желтый фосфор. По-сути, это разновидность белого, но не очищенная. Плотность вещества та же, воспламеняемость тоже.
Температура плавления чуть ниже – 34 градуса. Закипает элемент при 280-ти по шкале Цельсия. За счет загрязнений, при горении выделяется густой дым. С водой желтый фосфор, как и белый, в реакцию не вступает.
Существует еще
красный фосфор. Его впервые получили в 1847-ом году. Австрийский химик Шреттер нагрел белую модификацию элемента до 500-от градусов в атмосфере угарного газа.
Реакция проводилась в герметичной колбе. Полученный вид фосфора оказался термодинамически стабильным. Вещество растворяется разве что в некоторых расплавленных металлах.
Воспламениться
атом фосфораможет лишь при прогреве атмосферы до 250 градусов Цельсия. Альтернатива – активное трение, или сильный удар.
Цвет красного фосфора бывает не только алым, но и фиолетовым. Свечение отсутствует. Почти отсутствует и ядовитость. Токсичное действие красной модификации элемента минимально. Поэтому, именно алый фосфор широко используют в промышленности.
Предпоследняя модификация элемента – черная. Получена в 1914-ом году, является самой стабильной. У вещества металлический блеск. Поверхность черного фосфора лоснится, похожа на .
Модификация не поддается ни одному растворителю, воспламеняется лишь в атмосфере, прогретой до 400-от градусов.
Масса фосфорачерного наиболее велика, как и плотность. Вещество «рождается» из белого при давлении в 13 000 атмосфер.
Если довести давление до сверхвысокого, появляется последняя, металлическая модификация элемента. Ее плотность достигает почти 4-х граммов на кубический сантиметр.
Формула фосфоране меняется, но преобразуется кристаллическая решетка. Она становится кубической. Вещество начинает проводить электрический ток.
Применение фосфора
Оксид фосфораслужит дымообразующим средством. Воспламеняясь, желтая модификация элемента дает густую завесу, что пригождается в оборонной промышленности.
В частности, фосфор добавляют в трассирующие пуля. Оставляя за собой дымный след, они позволяют корректировать направление, точность посылов. «Дорожка» сохраняется на протяжении километра.
В военной промышленности фосфор нашел место, так же, как воспламенитель. В этой роли элемент выступает и в мирных целя. Так, красную модификации используют при изготовлении спичек. Смазкой в них служит пара
фосфор-сера, то есть, сульфид 15-го элемента .
Хлорид фосфора нужен при производстве пластификаторов. Так называют добавки, увеличивающие пластичность пластмасс и прочих полимеров. Хлорид закупают и аграрии. Они примешивают вещество к инсектицидам.
Их применяют для уничтожения вредителей на полях, в частности, насекомых. Опрыскивают посадки и пестицидами. В них присутствует уже дуэт
кальций-фосфорили же фосфиды .
Если насекомых с помощью фосфорных смесей убивают, то растения – взращивают. Так, пары
азот-фосфори
калий-фосфор– завсегдатаи удобрений. 15-ый элемент питает насаждения, ускоряет их развитие, повышает урожайность. Фосфор необходим и человеку.
В костях, нуклеиновых цепочках, белках, его скрыто примерно 800 граммов. Не зря же элемент был впервые добыт путем перегонки мочи. Запасы организма требуют ежедневного пополнения в размере 1,2-1,5 граммов. Они поступают с морепродуктами, бобовыми, сырами и хлебом.
Кислоты фосфорадобавляют в продукты и искусственным путем. Зачем? Разбавленная фосфорная кислота служит усилителем вкуса для сиропов, мармеладов и газированных напитков. Если в составе продукта указана Е338, речь идет о соединении с участием 15-го элемента таблицы Менделеева.
Применение фосфораприрода не связала с его свечением. Человек же сделал упор именно на это свойство. Так, львиная доля запасов элемента идет на производство красок. Составы для машин еще и защищают их от коррозии. Изобретены краски для и глянцевых поверхностей. Есть варианты для дерева, бетона, пластика.
Без 15-го элемента не обходятся многие синтетические моющие средства. В них содержится
магний. Фосфорсвязывает его ионы.
Иначе, эффективность составов снижается. Без 15-го элемента снижается и качество некоторых сталей. Их основа –
железо. Фосфор– лишь .
Добавка увеличивает прочность сплава. В низколегированных сталях фосфор нужен для облегчения их обработки и увеличении сопротивляемости коррозии.
Добыча фосфора
В таблице Менделеева фосфор 15-ый, но по распространенности на Земле – 11-ый. Вещество не редко и за пределами планеты. Так, в метеоритах содержится от 0,02 до 0,94% фосфора. Он найден и в образцах грунта, взятых с Луны.
Земные представители элемента – 200 минерал, созданные природой на его основе. В чистом виде фосфор не встречается. Даже в литосфере он представлен ортофосватом, то есть, окислен до высшей степени.
Чтобы выделить чистый элемент промышленники работают с фосфатом кальция. Его получают из фосфоритов и втораппатитов. Это 2 минерала, наиболее богатые 15-ым элементом. После реакции восстановления, остается 100-процентный фосфор.
В качестве восстановителя выступает кокс, то есть углерод. Кальций, при этом, связывают песком. Все это специалисты проделывают в электропечах. То есть, процесс выделения фосфора относится к электротермическим.
Таково получение белого или желтого фосфора. Все зависит от степени очистки. Что нужно сделать, чтобы перевести продукт в красную, черную, металлическую модификации, описано в главе «Химические и физические свойства элемента».
Цена фосфора
Есть фирмы и магазины, специализирующиеся на поставках химического сырья. Фосфор, как правило, предлагают в упаковках по 500 граммов и килограмму. За красную модификацию весом в 1 000 граммов просят около 2 000 рублей.
Белый фосфор предлагают реже и по цене примерно на 30-40% дешевле. Черная и металлическая модификации дорогостоящие и реализуются, как правило на заказ через крупные предприятия-производители.
Возможно, будет полезно почитать:
- Сонник: к чему снится луна
; - Железная дорога и поезд по соннику
; - Сонник ремень мужской Во сне видеть ремень красный мужской
; - Забор толкование сонника
; - К чему снится смерть мамы и нужно ли бояться?
; - Что сулит сон про родник К чему снится теплый источник
; - Дело об убийстве царской семьи: что говорят в РПЦ Телеграммы великой драмы
; - Чуть в стороне от царского пути
;
Полезные советы
СОВЕТ №1
При подготовке презентации о фосфоре, обратите внимание на его строение и свойства, включая химические и физические характеристики. Это поможет создать более полное представление о данном элементе.
СОВЕТ №2
Используйте наглядные материалы, такие как диаграммы, таблицы и фотографии, чтобы проиллюстрировать основные аспекты фосфора. Это поможет аудитории лучше усвоить информацию и запомнить ее.
СОВЕТ №3
Не забудьте включить в презентацию информацию о применении фосфора в различных областях, таких как сельское хозяйство, медицина, производство удобрений и другие. Это позволит показать практическую значимость изучаемого элемента.
Частые вопросы
Каково строение фосфора и какие у него свойства?
Фосфор — это химический элемент, обладающий различными модификациями, такими как белый, красный и черный фосфор. Белый фосфор является наиболее распространенной формой и обладает молекулярной структурой P4. Он обладает высокой реакционной способностью и может самовоспламеняться на воздухе. Красный и черный фосфор имеют другую кристаллическую структуру и обладают различными физическими и химическими свойствами.
Какие применения имеет фосфор?
Фосфор широко используется в различных областях, включая производство удобрений, пищевой промышленности, производство огнестойких материалов, лекарств и пиротехники. Он также играет важную роль в биологических процессах, таких как фосфорилирование в клетках.